|
|
|
|
|
Глава 11. Аминокислоты. Пептиды. Белки. Нуклеиновые кислоты Белки: классификация, пространственное строение и свойстваГемоглобин — глобулярный белок крови, основной компонент красных кровяных клеток — эритроцитов. Главная его функция состоит в переносе кислорода из лёгких к тканям организма, а также в транспортировке услекислого газа. Его четвертичная структура представляет собой устойчивое образование из четырёх субъединиц.
Лизоцим — глобулярный белок, содержащийся в слёзной жидкости, слизистых выделениях человека, яичном белке и т. д. Макромолекула включает 1 29 аминокислотных остатков и имеет относительно небольшую молекулярную массу — 14 600. Лизоцим — фермент, расщепляющий связи молекул полисахаридов, образующих стенки клеток бактерий, поэтому его присутствие в тканях придаёт им бактерицидные свойства.
Лизоцим был первым ферментом, исследованным в 1 965 г. методом рентгеноструктурного анализа.
Коллаген — фибриллярный белок, содержащийся в подкожном слое, сухожилиях, хрящах, зубных и костных тканях. На долю белков группы коллагена приходится до 25% белкового вещества в организмах млекопитающих. Существует несколько типов коллагена, однако все они построены из трёх полипептидных цепей, скрученных вместе в тройную спираль (см. рис. 72).
Биологические функции белков. Вспомним основные функции белков, известные вам из курса биологии.
Пластическая (строительная). Такие белки, как коллаген, участвуют в формировании клеток и тканей организма.
Транспортная. Эта функция связана с переносом (транспортировкой) в организме веществ. Например: альбумины переносят остатки жирных кислот, а гемоглобин доставляет кислород клеткам тканей.
Регуляторная. Многие гормоны и ферменты являются биологическими катализаторами биохимических реакций в организме, например инсулин, глюкоген и др.
Защитная. Некоторые белки, например иммуноглобулины крови, участвуют в механизме защиты организма от проникновения чужеродных белков при заболеваниях, вызванных бактериальной или вирусной инфекцией. Белки фибрин и тромбин способствуют свертыванию крови при ранах и травмах.
Рецепторная. Некоторые белки клеточных мембран входят в состав рецепторов, осуществляющих регуляцию функций организма.
Физико-химические свойства белков
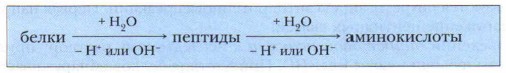
Многообразие белков определяет многообразие их свойств. Поэтому мы остановимся на их общей характеристике. Задание. Охарактеризуйте растворимость белков разных групп. Физические свойства и идентификация белковБелки не имеют точно определённой температуры плавления. Поэтому идентифицировать их по точке плавления нельзя. Для определения чистоты белка или его относительной молекулярной массы используется ультрацентрифугирование. Образцы белковых растворов помещают в специальный аппарат — ультрацентрифугу — и вращают с высокой скоростью. Скорость оседания белков и образования осадков зависит от их Мr, формы и плотности. Чистые и неочищенные белки имеют различные скорости осаждения. Химические свойства белков1. Гидролиз белков — реакция, обратная синтезу белков, осуществляется при действии ферментов или при длительном кипячении белков в присутствии сильных кислот или щелочей. В результате полного гидролиза белков получается смесь из аминокислот. Гидролиз белков имеет огромное значение в исследовании состава белков. Гидролиз белков протекает поэтапно по схеме.
2. Денатурация белков. Связи, поддерживающие пространственную структуру белка, относительно легко разрушаются, например при нагревании.
Первичная структу ра при денатурации сохраняется. Поэтому денатурация может быть обратимой при условии быстрого устранения фактора, её вызвавшего. Факторами, вызывающими денату рацию белков, являются: нагревание, воздействие минеральных кислот и солей тяжёлых металлов, некоторых органических растворителей и др. В отличие от этих факторов действие радиации вызывает необратимые изменения в структуре белков, что приводит к потере характерных для них свойств. Происходит восстановление пространственной структу ры белка — ренатурация. Такие же изменения происходят с волосами при их укладывании с помощью фена. Примером денатурации является свертывание при варке куриных яиц альбумина, который входит в состав их белка; казеина — при скисании молока (в результате деятельности молочнокислых бактерий возрастает кислотность среды). Это и становится причиной разрушения пространственной структуры казеина. В результате молоко загустевает. Образуется молочный сгусток, например при получении простокваши.
Денатурированные белки, в том числе кисломолочные, усваиваются организмом легче, поэтому пищу подвергают термической обработке. Ускоряют денатурацию действие радиации, резкое изменение кислотности среды, воздействие на белки различных реактивов (мочевины, квасцов и т. п.) и даже сильное продолжительное встряхивание или энергичное размешивание белкового раствора. 3. Качественные реакции на белки. Для обнаружения белков в растворе часто используются биуретовая и ксантопротеиновая реакции. Первая направлена на обнаружение пептидных связей. При проведении биуретовой реакции к исследуемому раствору приливают растворы щёлочи и соли меди(II). Присутствие белков обнаруживается по появлению фиолетовой окраски. Биуретовая реакция также применяется для определения концентрации белка в растворе. Интенсивность фиолетовой окраски, определяемая количественно с помощью УФ-спектроскопии, пропорциональна концентрации белка. Ксантопротеиновая реакция (от греч. xanthos — «рыжий») относится к числу частных реакций, позволяющих обнаружить определённые аминокислоты. Она осуществляется нагреванием раствора белка с концентрированной азотной кислотой. При этом возникает жёлтое окрашивание. При ожоге кожи азотной кислотой появляется жёлтое пятно. В результате нитрования бензольных колец боковых цепей аминокислотных радикалов удаётся обнаружить фенилаланин, тирозин, гистидин, триптофан. Основные понятия Глобулярные, фибриллярные белки • Кератины • Коллагены • Первичная, вторичная, третичная, четвертичная структуры белка • Субъединица • Заменимые и незаменимые белки • Биологические функции белков • Гидролиз белков • Денатурация, ренатурация • Биуретовая, ксантопротеиновая реакции Вопросы и задания
|
|
|



 Некоторые важнейшие сведения об отдельных белках
Некоторые важнейшие сведения об отдельных белках
 Что можно сказать о растворимости белков разных групп?
Что можно сказать о растворимости белков разных групп?
 1. Эластины — белки, образующие некоторые ткани лёгких, связок, артерий. Какими физическими свойствами должны обладать белки этой группы? Какие предположения относительно их структуры можно сделать?
1. Эластины — белки, образующие некоторые ткани лёгких, связок, артерий. Какими физическими свойствами должны обладать белки этой группы? Какие предположения относительно их структуры можно сделать?
 3. Приведите примеры глобулярных и фибриллярных белков. Составьте сравнительную таблицу, отражающую их возможно более полные характеристики.
3. Приведите примеры глобулярных и фибриллярных белков. Составьте сравнительную таблицу, отражающую их возможно более полные характеристики.
 5. Какие проблемы возникают на пути синтеза пептидов и белков. Как они преодолеваются? Используйте для ответа дополнительные источники информации, в том числе Интернет.
5. Какие проблемы возникают на пути синтеза пептидов и белков. Как они преодолеваются? Используйте для ответа дополнительные источники информации, в том числе Интернет.