|
|
|
|
|
Глава 11. Аминокислоты. Пептиды. Белки. Нуклеиновые кислоты § 35. Белки: классификация, пространственное строение и свойства
Классификация белковБелки исключительно многообразны. В основу их классификации могут быть положены состав, пространственное строение, биологическая функция и другие признаки. Состав белков Белки подразделяются на простые и сложные. При гидролизе простых белков образуются не только аминокислоты, но и пептиды. Сложные белки наряду с полииептидными цепями содержат фрагменты небелковой природы. В живых организмах белки существуют обычно в составе сложных образований с высоким уровнем организации. Например, в состав транспортных белков гемоглобина и миоглобина наряду с белковой частью — глобином — входит и небелковая — гем, содержащий ионы железа. Рассмотрим классификацию белков по их строению и структу ре. Пространственное строение белков
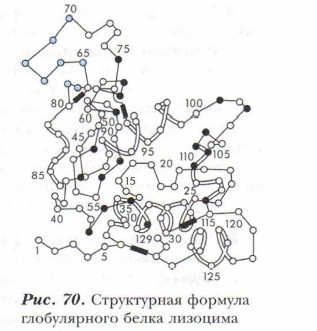
Белки подразделяются на два больших класса: глобулярные (от лат. globus — «шар») и фибриллярные (от лат. fibra — «волокно»). Глобулярные белки (это все биологические катализаторы — ферменты, антитела) имеют компактную сферическую структу ру. Белки-шарики растворимы в воде (рис. 70, 73). Фибриллярные белки имеют вытянутые в пространстве нитевидные структуры, нерастворимы в воде. Типичными представителями белков-нитей являются миоино- зины (образуют мышечную ткань), кератины (содержатся в волосах, перьях, рогах), коллагены (содержатся в коже, в соединительных тканях), эластины (образуют некоторые ткани лёгких, связок, артерий), а также фиброин натурального шёлка. Структура белковБелки обладают очень сложной структурой. Выделяют четыре различных уровня организации структуры белков: первичную, вторичную, третичную и четвертичную структуры. Первичная структура белка определяется последовательностью аминокислотных остатков в полипентидной цепи, связанных ковалентными (пептидными или амидными) связями. Последовательность аминокислотных остатков в двух полипептидных цепях образует молекулу белка инсулина (см. рис. 70). Такой белок присутствует в организме всех млекопитающих.
Вторичная структура белковых молекул определяется возникновением внутри них множества водородных связей, которые способствуют свертыванию полипептидной цепи в спираль.
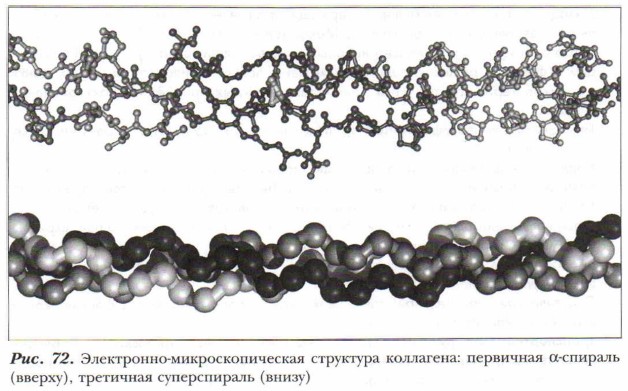
Во многих белках, особенно в глобулярных, часть (а в некоторых — большая часть) полипептидной цепи уложена в форме спирали. В фибриллярных белках образование водородных связей приводит к возникновению складчатой (листовой) структуры, например коллагена (рис. 72).
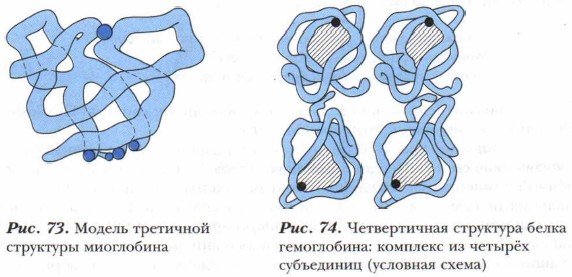
Третичной структурой называется конфигурация, свёрнутая в пространстве и «сшитая» полипептидной цепью (рис. 73). Третичная структура может быть образована с помощью:
Классическими примерами белков, имеющих четвертичную структуру, являются гемоглобин и миоглобин (рис. 74).
|
|
|



 Что вам известно о белках из курса биологии?
Что вам известно о белках из курса биологии?

 В первую очередь водородные связи возникают между атомами кислорода и азота из рядом расположенных карбоксильных групп и аминогрупп. Это приводит к тому, что полипептидная цепь приобретает упорядоченное свёртывание «остова». Исследовав различные виды ограничений вращения вокруг связей, американские учёные Л. Полинг и Р. Кори в I 950 г. доказали, что одним из наиболее выгодных расположений для полипептидной цепи является её укладывание в форме спирали (рис. 71).
В первую очередь водородные связи возникают между атомами кислорода и азота из рядом расположенных карбоксильных групп и аминогрупп. Это приводит к тому, что полипептидная цепь приобретает упорядоченное свёртывание «остова». Исследовав различные виды ограничений вращения вокруг связей, американские учёные Л. Полинг и Р. Кори в I 950 г. доказали, что одним из наиболее выгодных расположений для полипептидной цепи является её укладывание в форме спирали (рис. 71).