|
|
|
|
|
Глава 4. Теоретические основы, механизмы и закономерности протекания реакций органических соединений § 5. Теоретические основы протекания реакций органических соединенийПоскольку реакции органических соединений подчиняются общим теориям и закономерностям протекания химических реакций, из курса химии основной школы необходимо вспомнить следующие общие понятия:
Задание. Каковы причины протекания химических реакций? Раскройте их на примере реакции синтеза воды. Что такое тепловой эффект химической реакции и как он обозначается? На примере горения метана в кислороде раскройте сущность этого процесса и запишите термохимическое уравнение. Реакции органических соединений подчиняются общим законам:
Эти реакции объясняются и прогнозируются положениями изученных теорий и закономерностями их протекания. Вы уже встречались с понятием «система» и в курсе биологии, и в курсе химии основной школы (в частности, знакомы с молекулой, веществом, раствором как системами). В химии под системой понимают вещество или совокупность веществ, а также их процессы. В химической реакции вещества и их частицы являются реагентами и продуктами реакции. Поэтому химическую систему рассматривают и как реакционную смесь. Химические системы подразделяют на гомогенные и гетерогенные. Гомогенная система — это химическая система, в которой компоненты находятся в одной фазе или в одном агрегатном состоянии (чаще всего жидком, или газообразном), где между компонентами практически отсутствует граница. Примером может служить состояние веществ в реакции: С2Н5ОН + НВr → С2Н5Вr + Н2О где все вещества находятся в жидкой фазе. Гетерогенная система — это химическая система, в которой компоненты находятся в разных агрегатных состояниях (фазах) или в виде не- смешивающихся жидкостей. В отличие от гомогенных реакций гетерогенные протекают на поверхности раздела между реагентами. Примером может служить реакция: 2СН3СООН + Mg → (CH3COO)2Mg + Н2↑ где вещества находятся и в жидком, и в твёрдом, и в газообразном состоянии. В соответствии с приведёнными выше примерами, химические реакции делятся на гомогенные и гетерогенные. Для установления зависимости строения и свойств веществ, для характеристики их химических реакций важно использовать понятие «реакционная способность».
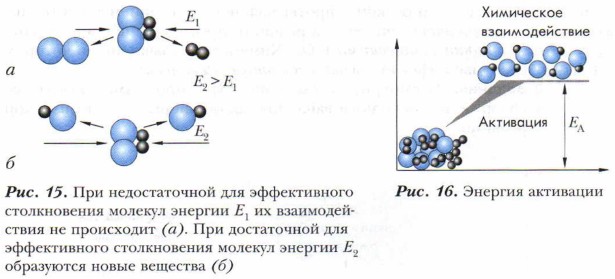
Реакционная способность веществ, участвующих в химической реакции, измеряется скоростью данной химической реакции. Как вы знаете из курса основной школы, скорость химической реакции (υ) определяется изменением концентрации одного из вступивших в реакцию или образующихся в результате реакции веществ в единицу времени и выражается в молях на литр в секунду (моль/л • с). На скорость химической реакции влияют многие факторы: катализатор, поверхность соприкосновения веществ, температура, давление, природа реагентов и др. Даже в какой-либо конкретной реакции реакционная способность одного из реагентов может широко варьироваться под влиянием другого. Задание. Приведите примеры опытов, доказывающих влияние отдельных факторов на скорость химической реакции. Химическая реакция и образование частиц — продуктов реакции происходит в том случае, если частицы реагентов обладают достаточной энергией (рис. 15).
Энергия, необходимая для начала химического взаимодействия, называется энергией активации (рис. 16). Она нужна для эффективного столкновения молекул, приводящего к их взаимодействию. Чем меньше величина энергии активации, тем выше скорость реакции. Все реакции (как органических, так и неорганических соединений) сопровождаются изменением энергии химической системы.
|
|
|