|
|
|
|
|
Глава 4. Теоретические основы, механизмы и закономерности протекания реакций органических соединений Особенности и классификация органических реакцийКлассификация по направлению и конечному результату (продукту) химического превращенияПо этим признакам органические реакции делят на три основных типа: замещения, присоединения, элиминирования, перегруппировки. Часто выделяют и такие, как окисление и восстановление. С примерами всех этих типов реакций вы уже знакомы из курса химии 9 класса. 1. Реакции замещения. Под замещением понимают замену атома или группы атомов на другой атом или группу атомов. В результате реакции замещения образуются два разных продукта. К таким реакциям относятся: галогенирование и нитрование алканов; этерификация и алкилирование карбоновых кислот; многочисленные реакции простых полярных молекул (Н2O, NH3, Сl2, I2, Вr2 и др.) с эфирами, спиртами, галогенопроизводными.
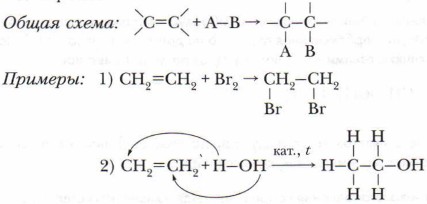
Задание. Приведите примеры каждого из перечисленных выше видов замещения и докажите принадлежность к данному типу и виду реакций. 2. Реакции присоединения. Под реакцией присоединения понимают введение атома или группы атомов в молекулу непредельного соединения, что сопровождается разрывом в этом соединении гс-связей. В ходе взаимодействия двойные связи превращаются в одинарные, а тройные — в двойные или одинарные.
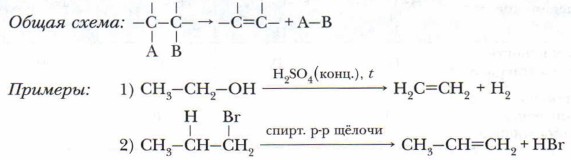
К реакциям присоединения относятся и реакции полимеризации (см. учебник химии для 9 класса), например: СН2=СН2+СН2=СН2+СН2=СН2+... → ...-СН2-СН2-СН2-СН2-СН2-СН2-... Проблема. Докажите принадлежность реакции полимеризации к типу реакций присоединения и приведите пример такой реакции. 3. Реакции элиминирования, или отщепления. Это реакции, в ходе которых происходит отщепление атомов или их групп от органической молекулы с образованием кратной связи (дегидрования, дегидратации и др.).
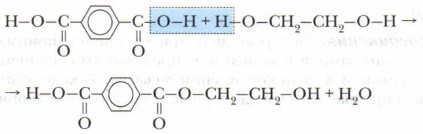
Реакции отщепления возможны при достаточно высоких температурах. При этом отщепляются, как правило, энергетически стабильные частицы — молекулы веществ (Н2O, СО, СО2, и др.). Пример — получение полиэфира лавсана:
Вначале при отщеплении одной молекулы Н2O образуется сложный эфир, на одном конце молекулы которого карбоксильная группа, а на другом — группа —ОН. Затем они вступают в реакцию с такими же молекулами, образуя полимер лавсан:
Полиэфир лавсан (на этикетках часто пишут просто «лавсан») широко используют для изготовления разных тканей, плёнок, бутылок и др.
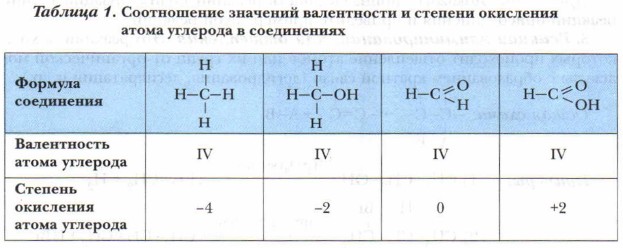
Реакции окисления и восстановления сопровождаются изменением степени окисления атома углерода в соединениях, где атом углерода — реакционный центр. Обратите внимание, что значения валентности и степени окисления углерода в органических соединениях не всегда совпадают (табл. 1).
Рассмотрим примеры реакций окисления и восстановления органических веществ.
Пример 1. Реакция окисления характеризуется образованием новых связей углерода с более электроотрицательным элементом (галогеном, кислородом, азотом, серой и др.) и повышением положительной степени окисления атома углерода. Атом-окислитель (или восстановитель) указан в квадратных скобках.
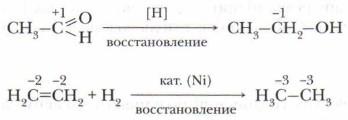
Пример 2. Реакция восстановления характеризуется увеличением отрицательной степени окисления атома углерода и образованием новых связей С—Н:
В ходе изучения органической химии вы будете иметь дело с самыми разнообразными реакциями органических веществ, относящимися к различным типам. Вы будете постоянно обращаться к данной главе, дающей общие представления об этих реакциях и их типах, конкретизируя их и расширяя знания о них. Алгоритм описания реакций поможет вам в решении этой задачи. Алгоритм описания химической реакции1. Схема реакции, особенности и условия её протекания. 2. Общая характеристика природы исходных веществ (реагентов), их реакционной способности (на примере конкретной реакции). 3. Принципиальная возможность и направление химической реакции. 4. Скорость химической реакции, влияние факторов на неё. 5. Характеристика химической реакции (тепловой эффект, обратимость, катализ и т. д.). 6. Сущность и механизм химической реакции. 7. Закономерности протекания данной химической реакции. 8. Тип химической реакции и доказательство её принадлежности к данному типу. Выводы 1. Реакции органических соединений подчиняются общим законам (закону сохранения массы и энергии и др.) и общим закономерностям их протекания (энергетическим, кинетическим — раскрывающим влияние природы веществ и различных факторов на скорость реакции). 2. Они имеют общие для всех реакций признаки, но имеют и свои характерные особенности. 3. По механизму протекания реакции органических веществ делятся на гомолитические (свободнорадикальные) и гетеролити- ческие (электрофильно-нуклеофильные). 4. По направлению и конечному результату химического превращения различают реакции: замещения, присоединения, элиминирования. поликонденсации, окисления и восстановления. Основные понятия Особенности реакций органических соединений • Механизм реакций • Нуклеофил и электрофил • Радикал • Классификация по механизму реакций: гомолитические и гетеролитические (нуклеофильные-электрофильные) • Классификация по направлению и продуктам: замещения, присоединения, элиминирования, поликонденсации, окисления и восстановления Вопросы и задания
|
|
|



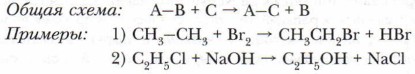
 Реакции поликонденсации относятся к реакциям замещения, но их часто выделяют как особый тип органических реакций, имеющих специфику и большое практическое значение. Это реакции, в ходе которых из низкомолекулярных веществ получаются высокомолекулярные соединения (полимеры) и как побочный продукт образуется новое низкомолекулярное вещество (вода и др.).
Реакции поликонденсации относятся к реакциям замещения, но их часто выделяют как особый тип органических реакций, имеющих специфику и большое практическое значение. Это реакции, в ходе которых из низкомолекулярных веществ получаются высокомолекулярные соединения (полимеры) и как побочный продукт образуется новое низкомолекулярное вещество (вода и др.).
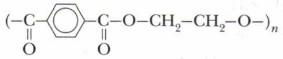
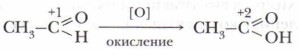
 1. Дайте определение и примеры реагентов — нуклеофилов и электрофилов.
1. Дайте определение и примеры реагентов — нуклеофилов и электрофилов.
 3. На примере знакомых химических реакций покажите, как происходит разрыв (расщепление) ковалентных связей в молекулах исходных веществ.
3. На примере знакомых химических реакций покажите, как происходит разрыв (расщепление) ковалентных связей в молекулах исходных веществ.