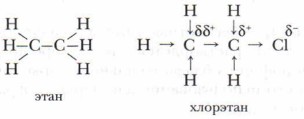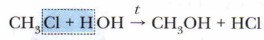|
|
|
|
|
Глава 5. Углеводороды § 9. Физические и химические свойства алканов и их применение
Явление гомологии в химии имеет важное значение. Оно позволяет изучить свойства целого класса соединений на примере нескольких представителей гомологического ряда и установить закономерности изменения физических свойств гомологов, чтобы сделать выводы о свойствах других гомологов. Задание. Задание. Изучив таблицу 2 на с. 60, установите закономерности изменения физических свойств алканов. Рассмотрим свойства предельных углеводородов. Предельные углеводороды являются малоактивными и имеют ещё одно название — парафины (от лат. рагит — «мало» и affinis — «родство»). Проблема. Объясните причину невысокой химической активности алканов, рассмотрев их строение (см. § 2). Химические свойства алкановХимические свойства алканов проявляются в реакциях. 1. Реакция горения. При горении алканов выделяется большое количество теплоты (экзотермическая реакция), поэтому некоторые углеводороды используются в качестве топлива. Однако они горят по-разному, например, метан, этан, пропан, бутан сгорают полностью и горят бесцветным пламенем, а при горении гексана и гептана образуется много копоти. Почему? СН4 + 2O2 → СO2 + 2Н2O + 890 кДж Помните: смесь метана с воздухом или кислородом взрывоопасна! Наиболее сильный взрыв происходит при смешивании метана с кислородом в соотношении 1:2 или с десятью объёмами воздуха (1:10). Такая смесь может образовываться в каменноугольных шахтах, в котельных, в жилых помещениях.
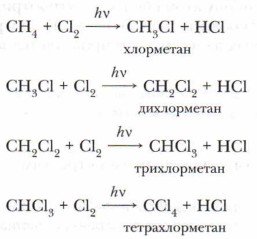
2. Реакции замещения. Для алканов характерны реакции радикального замещения, в ходе которых атом водорода замещается на атом галогена или какую-нибудь группу атомов. Атом углерода в предельных углеводородах находится в состоянии sр3-гибридизации. Это значит, что химические реакции, в которые они вступают, связаны с разрывом весьма прочных σ-связей (С—С и С—Н). А. Галогенирование. Примером может служить реакция с хлором, при которой происходит последовательное замещение атомов водорода на атомы хлора под действием света или нагревания.
Механизм этой реакции рассмотрен в § 6. В разработку цепных реакций большой вклад внесли отечественный физик, академик Н.Н. Семёнов и английский учёный С. Хиншелвуд, удостоенные Нобелевской премии. Проблема. Как объяснить, что в реакциях радикального замещения (гало- генирования) алканов легче всего замещаются атомы водорода у третичных, а затем у вторичных и первичных атомов углерода?
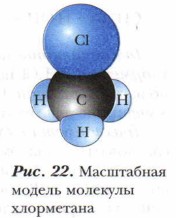
В реакции галогенирования алканов образуются вещества, которые называются галогеноуглеводородами. Они являются одними из важнейших соединений в органическом синтезе. Реакционная способность галогеноалка- нов определяется характером связи «углерод — галоген» и структурой молекулы. В случае хлорирования метана в хлорметане образуется связь С—Сl, в результате чего молекула принимает форму неправильного тетраэдра (рис. 22). То же происходит и с этаном.
В итоге электронная плотность в молекуле хлорэтана по сравнению с молекулой этана смещена в сторону атома хлора. Связь «углерод — углерод» становится полярной. Полярность одной ковалентной связи является причиной смещения электронной плотности соседних σ-связей в сторону атома более электроотрицательного элемента. В случае введения в углеродную цепь более электроотрицательных или более электроположительных заместителей проявляется индуктивный эффект.
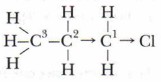
Смещение электронной плотности обозначают прямыми стрелками. Однако, влияние атома хлора в молекуле 1-хлорпропана на третий атом углерода практически не сказывается:
При увеличении углеводородного радикала индуктивный эффект в цепочке атомов быстро затухает. Влияние атомов в молекуле взаимно. Радикал (метил), в свою очередь, влияет на атом хлора: метан не взаимодействует с водой, а хлорметан вступает в реакцию гидролиза:
Галогеналканы широко используются в хозяйстве страны. Например, хлорметан СН3Сl используется в качестве хладагента в холодильных установках. Хлорэтан С2Н5Сl — легкоиспаряющаяся жидкость, применяется в медицине для местной анестезии. Трихлорметаи (хлороформ) СНСl3 — бесцветная тяжёлая жидкость со сладковатым запахом. Негорюч, почти не растворяется в воде, хорошо растворяет жиры, смолы, каучуки. Хлороформ обладает сильным наркотическим действием. В настоящее время его использование для наркоза ограничено из-за сравнительно высокой токсичности. Трииодметан (йодоформ) СНI3 — твёрдое вещество желтоватого цвета с резким характерным запахом. Применяется наружно как антисептическое средство в виде мазей и присыпок. Тетрахлорметан ССl4 — тяжёлая бесцветная жидкость с характерным запахом. Плохо растворим в спирте, эфире, практически нерастворим в воде. Негорюч, при соприкосновении с огнём испаряется. Тяжёлые пары тетра- хлорметана ограничивают доступ кислорода. На этом основано его использование в огнетушителях.
|
|
|



 Какие углеводороды называются предельными, или насыщенными, и почему они так называются? В каком валентном состоянии находится каждый атом углерода в предельных углеводородах?
Какие углеводороды называются предельными, или насыщенными, и почему они так называются? В каком валентном состоянии находится каждый атом углерода в предельных углеводородах?

 Решение этой проблемы связано с энергией связей С—Н в простейших алканах. В этане она составляет 417 кДж/моль, для звена СН2 в пропане — 396 кДж/моль, в изобутане для звена СН — 376 кДж/моль.
Решение этой проблемы связано с энергией связей С—Н в простейших алканах. В этане она составляет 417 кДж/моль, для звена СН2 в пропане — 396 кДж/моль, в изобутане для звена СН — 376 кДж/моль.