|
|
|
|
|
Глава 5. Углеводороды Физические и химические свойства алканов и их применениеВпервые реакцию нитрования алканов провёл русский химик М.И. Коновалов в 1888 г. Эта реакция носит его имя. Реакция нитрования, как и реакция галогенирования, идёт по свободнорадикальному механизму. Нитроалканы используются для получения взрывчатых веществ и ракетного топлива.
3. Реакция отщепления (дегидрирования). В этой реакции от молекулы алкана отщепляется молекула водорода. Дегидрирование протекает в присутствии катализаторов (Ni, Pd) при повышенной температуре, мри этом образуются этиленовые углеводороды.
4. Реакция изомеризации (перегруппировки). При нагревании алканов нормального строения в присутствии катализатора — хлорида алюминия АlСl3 — происходит образование углеводородов разветвлённого строения. Такая реакция получила название реакции изомеризации.
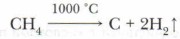
5. Реакция разложения: а) при высокой температуре происходит разложение предельных углеводородов — крекинг (от англ, cracking — «расщепление»). Крупные молекулы алканов превращаются в вещества с более короткой цепью атомов углерода. Если процесс проводится в присутствии катализатора, то крекинг называется каталитическим, без катализатора — термическим. Продуктом реакции является смесь предельных и непредельных углеводородов: С8Н18 → С4Н10 + С4Н8 б) при нагревании алканов до 1000 °С происходит разложение на простые вещества углерод и водород — пиролиз:
в) при нагревании до 1500 °С происходит образование ацетилена и водорода:
г) конверсия метана. При взаимодействии метана с нагретым водяным паром в присутствии никелевого катализатора образуется смесь оксида углерода (II) и водорода, называемая синтез-газом. Его используют для получения синтетического бензина и кислородсодержащих органических соединений:
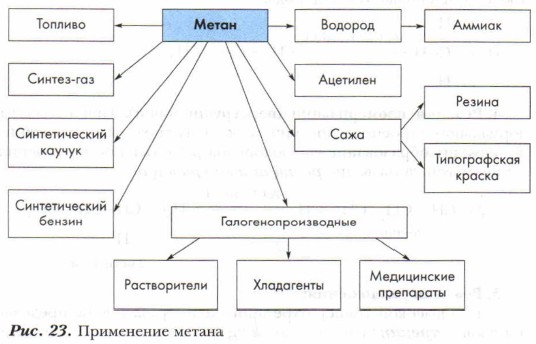
Применение алкановАлканы широко используются как топливо и как сырьё химической промышленности. Задание. Используя предложенную схему (рис. 23), расскажите о применении метана, основанном на его свойствах. Там, где возможно, запишите уравнения химических реакций.
Получение алкановС промышленными способами получения алканов мы будем знакомиться позже. Когда требуется увеличить в углеродной цепи число атомов углерода, используют эту реакцию. Под действием атомов металла из молекул галогеналкана образуются два радикала, которые соединяются между собой и образуют новое вещество. Эту реакцию открыл французский учёный Ш.-А. Вюрц в 1855 г., и она носит его имя.
Основные понятия Алканы • Реакция радикального замещения (галогенирование, нитрование) • Индуктивный эффект • Дегидрирование • Изомеризация • Крекинг • Пиролиз • Реакция Вюрца Вопросы и задания
С2Н6 → С2Н5Вr → С2Н8 → СО2
а) 1; б) 2; в) 3; г) 4.
|
|
|



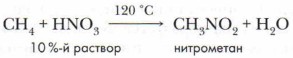
 Б. Нитрование. Предельные углеводороды не взаимодействуют с кислотами при обычной температуре, даже с концентрированными. Однако при нагревании и небольшом повышении давления алканы вступают в реакцию замещения с разбавленной азотной кислотой. В результате этой реакции происходит замещение атома водорода в молекуле алкана на нитрогруппу —NO2:
Б. Нитрование. Предельные углеводороды не взаимодействуют с кислотами при обычной температуре, даже с концентрированными. Однако при нагревании и небольшом повышении давления алканы вступают в реакцию замещения с разбавленной азотной кислотой. В результате этой реакции происходит замещение атома водорода в молекуле алкана на нитрогруппу —NO2:
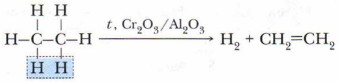
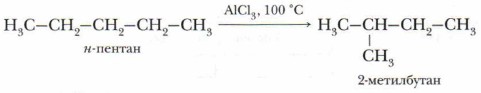
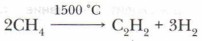

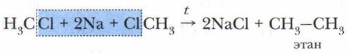
 1. Напишите уравнения химических реакций горения этана, пропана. Вычислите по уравнению каждой реакции объём образовавшегося оксида углерода(IV) (н. у.), если прореагировало по 5 л алканов.
1. Напишите уравнения химических реакций горения этана, пропана. Вычислите по уравнению каждой реакции объём образовавшегося оксида углерода(IV) (н. у.), если прореагировало по 5 л алканов.
 2. Составте схему взаимодействия этана с хлором с указанием разыва связи С—Н.
2. Составте схему взаимодействия этана с хлором с указанием разыва связи С—Н.
 7. Назовите наиболее опасные для всей планеты вещества-загрязнители, являющиеся производными метана и этана. В чём состоит их опасность? Найдите информацию, используя Интернет.
7. Назовите наиболее опасные для всей планеты вещества-загрязнители, являющиеся производными метана и этана. В чём состоит их опасность? Найдите информацию, используя Интернет.