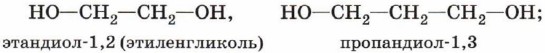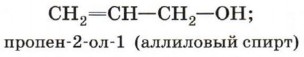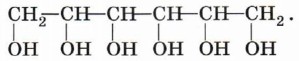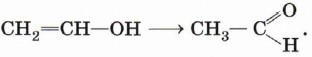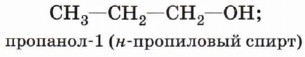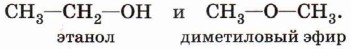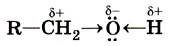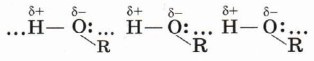|
|
|
|
|
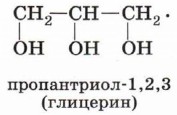
Глава 4. Кислородсодержащие соединения § 17. СпиртыСтроение спиртовПо числу гидроксильных групп (атомности) спирты делятся на следующие группы:
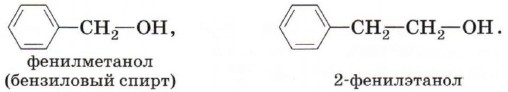
По характеру углеводородного радикала выделяют спирты:
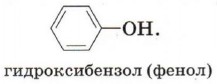
Органические вещества, содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например:
Подробнее со строением, свойствами и применением фенолов мы познакомимся в § 18. Существуют и полиатомные (многоатомные) спирты, содержащие более трёх гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит):
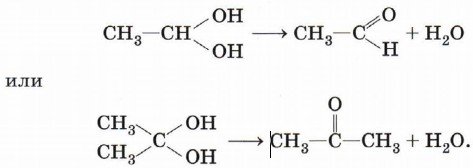
Следует заметить, что спирты, содержащие две гидроксильные группы при одном атоме углерода, неустойчивы и самопроизвольно разлагаются (подвергаются дегидратации) с образованием альдегидов или кетонов:
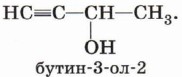
Непредельные спирты, содержащие гидроксильную группу у атома углерода, связанного двойной связью, называются енолами. Нетрудно догадаться, что название этого класса соединений образовано из суффиксов -ен и -ол, указывающих на присутствие в молекулах двойной связи и гидроксильной группы. Енолы, как правило, неустойчивы и самопроизвольно превращаются (изомеризуются) в карбонильные соединения — альдегиды и кетоны. Эта реакция обратима, а сам процесс, как вы уже знаете, называют кето-енолъной таутомерией. Так, простейший енол — виниловый спирт чрезвычайно быстро изомеризуется в уксусный альдегид:
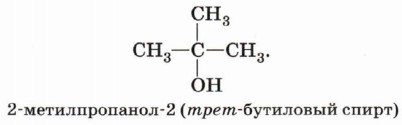
По характеру атома углерода, с которым связана гидроксильная группа, спирты делятся на три группы:
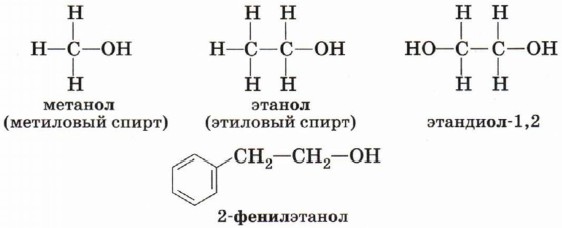
Номенклатура и изомерия спиртовПри образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют (родовой) суффикс -ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами (ди-, три , тетра- и т. д.) — их число.
В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
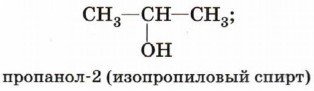
Начиная с третьего члена гомологического ряда у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвёртого — изомерия углеродного скелета (бутанол-1; 2-метилпропанол-1). Для них характерна и межклассовая изомерия — спирты изомерны простым эфирам:
Физические свойства спиртовНизшие и средние члены ряда предельных одноатомных спиртов, содержащие от одного до одиннадцати атомов углерода, — жидкости. Высшие спирты (начиная с С12Н25ОН) при комнатной температуре — твёрдые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, например октанол уже не смешивается с водой. Атом кислорода, входящий в гидроксильную группу молекул спиртов, отличается от атомов водорода и углерода по способности притягивать и удерживать электронные пары. Благодаря этому в молекулах спиртов имеются полярные связи С—О и О—Н.
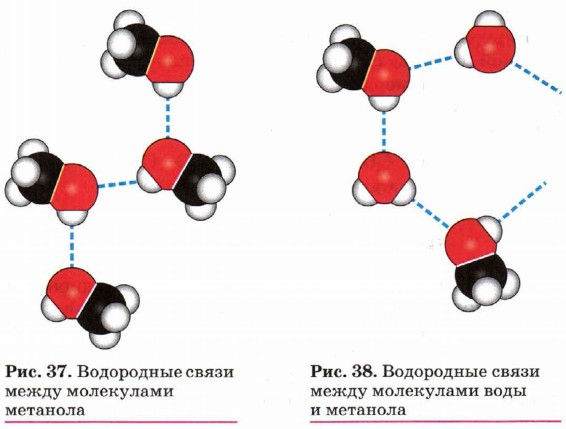
Вследствие полярности связи О—Н и значительного частичного положительного заряда, локализованного (сосредоточенного) на атоме водорода, водород гидроксильной группы имеет кислотный характер. Этим он отличается от атомов водорода, входящих в углеводородный радикал. Необходимо отметить, что атом кислорода гидроксильной группы имеет частичный отрицательный заряд и две неподелённые электронные пары, что даёт возможность спиртам образовывать особые, так называемые водородные связи между молекулами (рис. 37, 38).
Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы.
Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан (Мr(С3Н8) = 44) при обычных условиях является газом, а простейший из спиртов — метанол (Мr(СН3ОН) = 32) в обычных условиях жидкость.
|
|
|