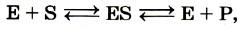|
|
|
|
|
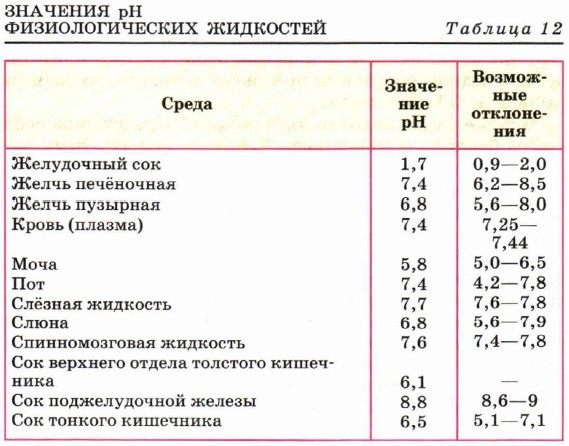
Глава 7. Биологически активные соединения ФерментыФерменты наиболее эффективно действуют на субстрат при строго определённой среде раствора, при определённых значениях так называемого рН (водородный показатель). Величина рН характеризует кислотность и основность растворов и может принимать значения от 1,0 до 14,0. Более подробно с водородным показателем рН вы будете знакомиться в курсе химии 11 класса. Кислотность или основность среды физиологических жидкостей определяет биологическую активность клеток организма, которая, в свою очередь, определяется «работой» действующих в них ферментов. Каждая из физиологических жидкостей имеет определённое значение рН (табл. 12), и отклонение от нормы может быть причиной тяжёлых заболеваний.
В простейшем случае уравнение реакции с участием фермента имеет вид:
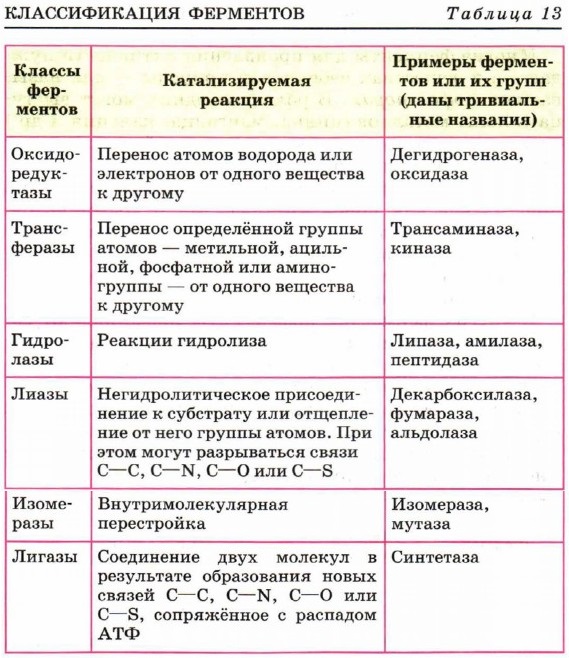
где Е — фермент, S — субстрат, ES — фермент-субстратный комплекс (комплекс Михаэлиса), Р — продукт реакции. Превращение субстрата в продукт происходит в комплексе Михаэлиса. В контакт с субстратом вступает лишь очень небольшая часть молекулы фермента, так называемый активный центр. Он включает обычно от 3 до 15 аминокислотных остатков полипептидной молекулы фермента. Высокая специфичность фермента обусловлена особой формой его активного центра, которая точно соответствует форме молекулы вещества катализируемой реакции (субстрата). Их можно сравнить с ключом и замком: катализируемое вещество выступает в роли «ключа», который точно подходит к «замку», т. е. к ферменту. Часто субстрат образует ковалентные связи с функциональными группами активного центра. Многие ферменты для проявления активности нуждаются в веществах небелковой природы — так называемых кофакторах. В роли последних могут выступать ионы металлов (цинка, марганца, кальция и др.) или молекулы органических соединений; в последнем случае их называют коферментами. Иногда для действия фермента бывает необходимо присутствие как ионов металла, так и коферментов. В некоторых случаях кофермент очень прочно соединён с белком, как, например, у каталазы, где кофермент представляет собой комплексное соединение железа с белком — гемоглобин. В других ферментах коферменты представляют собой вещества, близкие к витаминам, которые являются предшественниками коферментов. Например, из витамина В1 (тиамина) в клетках образуется тиаминпиро- фосфат — кофермент важного фермента, входящего в группу декарбоксилаз; из витамина В12 образуются коферменты, необходимые для усвоения жирных кислот с нечётным числом атомов углерода. Номенклатура ферментовКак же классифицируют ферменты? В 1961 г. специальной комиссией Международного биохимического союза была предложена систематическая номенклатура ферментов. Согласно ей ферменты были поделены на шесть групп в соответствии с общим типом реакции, которую они катализируют. Каждый фермент при этом получил систематическое название, точно описывающее катализируемую им реакцию. Однако, поскольку многие из этих систематических названий оказались очень длинными и сложными, каждому ферменту было также присвоено и тривиальное, рабочее название, предназначенное для повседневного употребления. В большинстве случаев оно состоит из названия вещества, на которое действует фермент, указания на тип катализируемой реакции и окончания -аза (табл. 13).
|
|
|