|
|
|
|
|
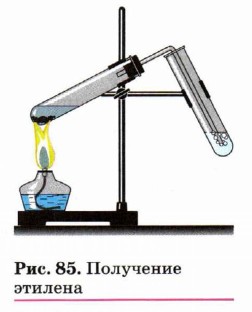
Практическая работа № 2 Практическая работа № 2. УглеводородыПолучение и свойства метанаВ пробирку поместите выданную учителем смесь безводного ацетата натрия и натронной извести 1 : 2 . Пробирку закройте пробкой с газоотводной трубкой и закрепите наклонно вверх в лапке штатива. Содержимое пробирки нагрейте в пламени спиртовки. Напишите уравнение протекающей реакции. Выделяющийся газ пропустите через подкисленный раствор перманганата калия и бромную воду (если она отсутствует, то можно воспользоваться аналогом — йодной водой, которую готовят, приливая 2—3 капли спиртовой настойки иода к 1—2 мл воды). Что наблюдаете? Выделяющийся газ подожгите. Обратите внимание на характер горения. Напишите уравнение реакции горения метана. Вопросы 1. Почему не наблюдается изменения окраски раствора перманганата калия и бромной воды при пропускании через них метана? 2. О чём свидетельствует характер пламени метана? Получение и свойства этилена (этена)Пробирку на 1/4 заполните гранулами технического полиэтилена (содержащего следы катализатора Циглера—Натта), закройте пробкой с газоотводной трубкой и укрепите в лапке штатива горизонтально с небольшим наклоном (рис. 85). Содержимое нагрейте на пламени спиртовки. Напишите уравнение реакции деполимеризации полиэтилена.
Выделяющийся этилен пропустите через подкисленный раствор перманганата калия и бромную (йодную) воду. Что наблюдаете? Напишите уравнения протекающих реакций. Переверните пробку в пробирке газоотводной трубкой вверх (осторожно, горячая пробирка!) и подожгите выделяющийся этилен. Обратите внимание на характер пламени этилена, сравните его с пламенем метана. Напишите уравнение реакции горения этилена. Вопросы 1. Чем обусловлен различный характер горения метана и этилена? 2. Какими способами получают этилен в лаборатории и в промышленности? Напишите уравнения реакций. 3. Почему этилен обесцвечивает растворы бромной воды и перманганата калия? Получение и свойства ацетиленаВ сухой прибор для получения газов поместите 2 кусочка карбида кальция, завёрнутые в фильтровальную бумагу. С помощью пипетки добавьте в пробирку несколько капель насыщенного раствора хлорида натрия (с водой реакция протекает слишком бурно). Закройте прибор пробкой с газоотводной трубкой. Напишите уравнение реакции карбида кальция с водой. Выделяющийся газ пропустите через подкисленный раствор перманганата калия и бромную воду. Что наблюдаете? Подожгите газ у конца газоотводной трубочки. Отметьте характер горения ацетилена. По окончании опыта после того, как перестал выделяться ацетилен, выньте из пробирки пробку с газоотводной трубкой и добавьте в пробирку каплю раствора фенолфталеина. Что наблюдаете? Вопросы 1. Зачем кусочки карбида кальция заворачивают в фильтровальную бумагу? 2. Почему ацетилен обесцвечивает бромную воду и раствор перманганата калия? 3. Почему ацетилен горит коптящим пламенем? 4. Почему фенолфталеин изменяет окраску при добавлении к продуктам реакции гидролиза карбида кальция?
|
|
|