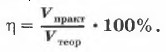|
|
|
|
|
Глава первая. Углеводороды и их природные источники § 12. Состав вещества. Смеси (окончание)Разновидностью понятия «доля» в химии является массовая доля выхода продукта реакции.
Аналогично находится и объёмная доля выхода продукта реакции:
Задача 6При восстановлении 12,3 г нитробензола получили 6,5 г анилина. Рассчитайте массовую долю выхода продукта реакции от теоретически возможного.
Ещё одним способом выражения концентрации растворов является молярная концентрация.
Чаще всего молярную концентрацию (молярность) выражают в моль/л.
1. Что называют массовой долей элемента в сложном веществе? Как её рассчитывают? 2. Что называют массовой (объёмной) долей компонента смеси? Как её рассчитывают? 3. Что такое доля примесей? Как найти массу (объём) чистого вещества, если известна массовая (объёмная) доля примесей? 4. Не производя расчёта, укажите, в каком из оксидов, формулы которых Fe2O3 и Fe3O4, содержание железа выше. Ответ подтвердите расчётами. 5. Рассчитайте массовые доли каждого из элементов в веществах: сульфат меди (II), нитрат железа (III), этиловый спирт, глюкоза, анилин. 6. К 120 г 60% -го раствора этилового спирта добавили 40 г безводного этилового спирта. Вычислите массовую долю этилового спирта в полученном растворе. 7. Из 280 г 15%-го раствора нитрата калия выпарили 120 мл воды. Вычислите массовую долю соли в полученном растворе. 8. Золото 585 пробы содержит 41,5% меди. Сколько граммов чистого золота содержит кольцо этой пробы, имеющее массу 2,8 г? 9. Вычислите объём кислорода, который может быть получен из 450 м3 воздуха (н. у.), если объёмная доля кислорода равна 21%. 10. Из 230 г 80% -го этилового спирта было получено 120 л этилена (н. у.). Рассчитайте выход этилена в процентах от теоретически возможного. 11. Вычислите объём (н. у.) оксида серы (IV), который может быть получен при сжигании 160 г серы, содержащей 25% примесей, если выход сернистого газа составляет 95% от теоретически возможного. 12. В 250 мл воды растворили 67,2 л (н. у.) хлороводорода. Вычислите массовую долю хлороводорода в полученном растворе. 13. В 120 мл раствора сульфата алюминия содержится 3,42 г соли. Определите молярную концентрацию раствора. 14. Найдите молярную концентрацию 15%-го раствора серной кислоты плотностью 1,1 г/мл.
|
|
|