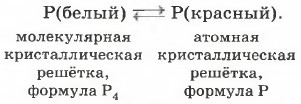|
|
|
|
|
Глава вторая. Химические реакции § 13. Понятие о химической реакции. Реакции, идущие без изменения состава веществХимия изучает не только свойства веществ, но и превращения одних веществ в другие, стремится использовать такие процессы для получения соединений с новыми, практически полезными свойствами.
Классификацию химических реакций можно проводить по самым различным признакам. Имеется достаточно большая группа реакций, которые не сопровождаются изменением состава веществ. В неорганической химии к таким реакциям можно отнести процессы взаимопревращения различных аллотропных модификаций одного химического элемента.
Очень интересно, а в настоящее время и практически значимо, например, превращение одной аллотропной модификации углерода — графита в другую — алмаз:
Этот процесс используют для получения искусственных алмазов. В 1954 г. учёные из лаборатории знаменитой американской фирмы «Дженерал электрик» получили чёрные кристаллики искусственных алмазов массой 0,05 г при давлении 100 тыс. атм и температуре 2600 °С. Такие алмазы стоили в сотни раз дороже природных. Но в течение десяти последующих лет были разработаны технологии, позволяющие получить в одной камере за несколько минут 20 г алмазов и более. Современное производство искусственных алмазов основано на их получении из графита не только при сверхвысоких, но и при низких давлениях. Такие алмазы сравнительно дёшевы. Они преимущественно используются в металлургии и машиностроении, радиоэлектронике и приборостроении, геологоразведке и горной промышленности. Аллотропные модификации серы:
мы достаточно подробно рассматривали ранее (см. рис. 76 на с. 89). Для наиболее известных аллотропных модификаций фосфора взаимопревращения можно отразить следующей схемой:
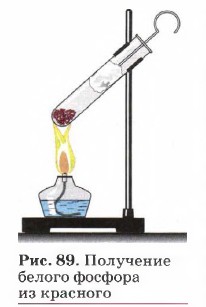
Исторически первым было осуществлено превращение белого фосфора в красный, когда немецкий алхимик X. Брандт в 1669 г., пытаясь получить так называемый философский камень прокаливанием сухого остатка мочи, получил светящиеся белые кристаллики вещества, названного им фосфором (от греч. «несущий свет»). Получить из красного фосфора белый можно и в школьной лаборатории (рис. 89).
Белое олово — это мягкий пластичный металл, с которым мы сталкиваемся чаще всего. Однако при понижении температуры оно может превращаться в серое олово — порошок, имеющий все свойства неметаллов. Этот процесс катализируется самим серым оловом: достаточно появиться всего лишь одной пылинке серого олова, как начинается реакция, которую уже невозможно остановить. При этом изделие из белого блестящего металла превращается в серый невзрачный порошок. Такой процесс носит образное название «оловянной чумы». Именно взаимопревращение аллотропных модификаций олова:
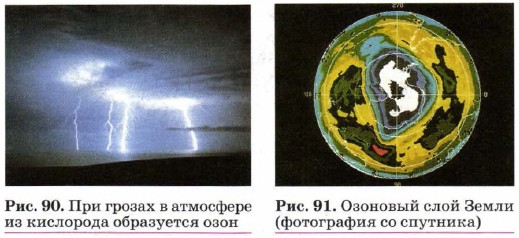
стало причиной гибели экспедиции Р. Скотта, пытавшегося в 1912 г. покорить Южный полюс. Экспедиция Р. Скотта использовала для хранения продуктов и керосина железные канистры, запаянные оловом. На сильном морозе оловянный припой рассыпался, и экспедиция осталась без топлива. Для многих других химических элементов также характерно явление аллотропии. Так, кислород образует две модификации — кислород O2 и озон O3. Превращение кислорода в озон происходит в природе при грозах (рис. 90). Впечатлённые этими природными явлениями поэты нередко допускают химические неточности типа: «В воздухе пахло грозой». А пахнет-то не грозой, а образующимся в результате её озоном (в переводе с греческого «озон» и означает «пахнущий»). О биологической роли защитного озонового экрана Земли вы уже знаете. Перед человечеством стоит насущная задача сохранить этот жизнеобеспечивающий экран от разрушения, так как с космических спутников приходят тревожные факты об уменьшении толщины озонового слоя атмосферы — так называемых озоновых дырах, которые на рисунке 91 показаны белым цветом.
|
|
|