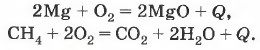|
|
|
|
|
Глава вторая. Химические реакции § 14. Классификация химических реакций, протекающих с изменением состава веществ (продолжение)Эти реакции характеризуют свойства в первую очередь электролитов и в растворах протекают по правилу Бертолле, т. е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, вода). 1. Так, в результате реакции обмена между растворами иодида натрия и нитрата свинца (II) образуется красивый золотисто-жёлтый осадок иодида свинца (II) (рис. 100): 2NaI + Pb(NO3)2 = Pbl2↓ + 2NaNO3,
2. Если в раствор кислоты прилить раствор, содержащий карбонат-ион, то можно заметить образование газа: Na2CO3 + 2НСl = 2NaCl + CО2↑ + Н2O,
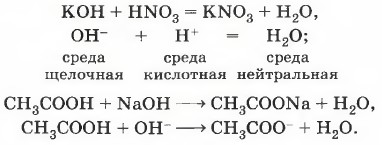
3. Если к раствору щёлочи добавить несколько капель фенолфталеина (окраска станет малиновой), а затем прилить кислоты, раствор обесцветится, так как произойдёт реакция нейтрализации:
Выделение или поглощение теплоты
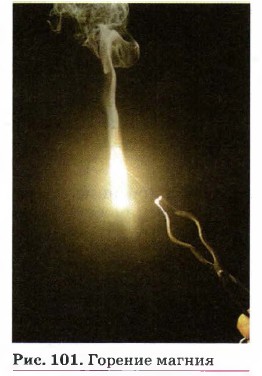
Частным случаем экзотермических реакций являются реакции горения — экзотермические реакции, протекающие с выделением света (рис. 101):
Многие реакции соединения протекают с выделением теплоты. Известным вам исключением является реакция соединения азота с кислородом в оксид азота (II), которая протекает с поглощением теплоты:
Следовательно, реакция синтеза оксида азота (II) относится к эндотермическим реакциям. Реакции разложения (химические антонимы реакциям соединения), за небольшим исключением, являются эндотермическими. Например, обжиг известняка — эндотермическая реакция: СаСO3 = СаО + СO2 - Q. Схематично экзо- и эндотермические реакции представлены на рисунке 102.
Например, горение углерода в кислороде — экзотермический процесс. Тепловой эффект реакции составляет 410 кДж/моль: С + O2 = СO2 + 410 кДж. Дегидрирование этана — реакция эндотермическая, её термохимическое уравнение имеет вид: С2Нб → С2Н4 + Н2 - 207 кДж.
|
|
|