|
|
|
|
|
Глава вторая. Химические реакции § 14. Классификация химических реакций, протекающих с изменением состава веществ (продолжение)В органической химии реакции разложения можно рассмотреть на примере их «антонимов» — реакций присоединения: дегидрирования этана, дегидратации этанола, деполимеризации полиэтилена (запишите уравнения реакций сами).
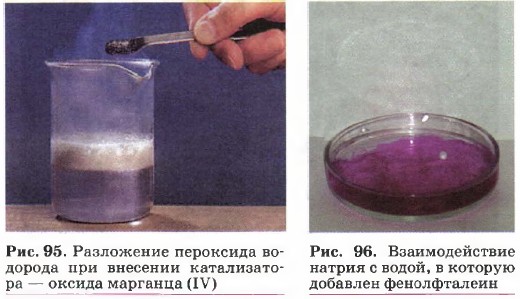
В неорганической химии примером таких процессов может служить блок реакций, характеризующих, например, свойства металлов. 1. Взаимодействие щелочных и щёлочноземельных металлов с водой (рис. 96): 2Na + 2Н2О = 2NaOH + Н2↑,
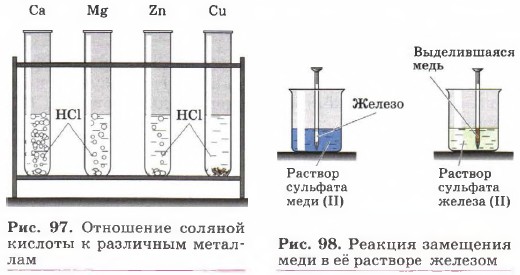
2. Взаимодействие металлов с растворами кислот (рис. 97): Zn + 2НСl = ZnCl2 + H2↑.
3. Взаимодействие металлов с растворами солей (рис. 98): Fe + CuSО4 = Си + FeSО4. 4. Металлотермия — вытеснение более активными металлами менее активных из их оксидов (рис. 99): 2Аl + Fe2О3 = Аl2О3 + 2Fe.
В органической химии, предметом изучения которой являются не простые вещества, а соединения, реакции замещения имеют свою специфику. Например, нитрование бензола — реакция, которая предшествует получению анилина: С6Н6 + HNO3 → C6H5NO2 + Н2O.
|
|
|