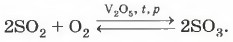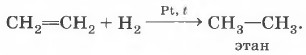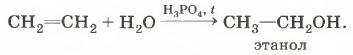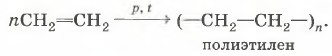|
|
|
|
|
Глава вторая. Химические реакции § 14. Классификация химических реакций, протекающих с изменением состава веществКлассификацию химических реакций, протекающих с изменением состава вещества, можно проводить по самым различным признакам. Число и состав реагентов и продуктов реакции
В неорганической химии всё многообразие реакций соединения можно рассмотреть, например, на блоке реакций получения серной кислоты из серы. 1. Получение оксида серы (IV) — из двух простых веществ образуется одно сложное: S + О2 = SO2. 2. Получение оксида серы (IV) — из простого и сложного веществ образуется одно сложное:
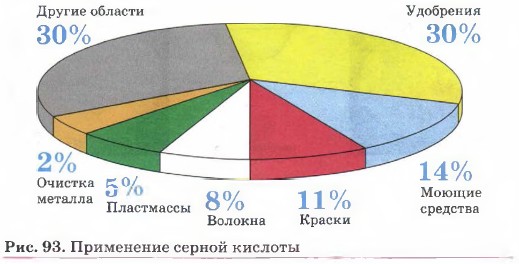
3. Получение серной кислоты — из двух сложных веществ образуется одно сложное: SО3 + Н2O = H2SO4. Мы выбрали этот пример не только потому, что он максимально иллюстрирует палитру реакций соединения, но также и потому, что продукт этих реакций — серная кислота — является «хлебом химической промышленности» (рис. 93).
В органической химии реакции соединения имеют специфику в названии, как вы помните, их называют реакциями присоединения. Всё многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных соединений, например этилена. 1. Реакция гидрирования — присоединения водорода:
2. Реакция гидратации — присоединение воды:
3. Реакция полимеризации:
В неорганической химии всё многообразие таких реакций можно рассмотреть на блоке реакций получения кислорода лабораторными способами.
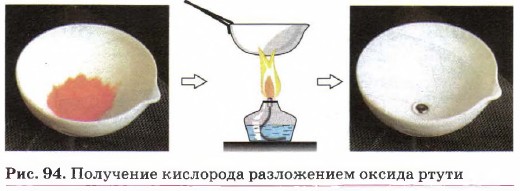
1. Разложение оксида ртути (II) при нагревании: 2HgO = 2Hg + О2↑. Именно этим способом Дж. Пристли впервые получил кислород (рис. 94). 2. Разложение пероксида водорода (рис. 95): 2Н2О2 = 2Н2О + О2↑. 3. Разложение перманганата калия при нагревании: 2КМnО4 = К2МnО4 + МnО2 + О2↑.
|
|
|