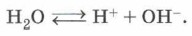|
|
|
|
|
Глава вторая. Химические реакции § 19. Окислительно-восстановительные реакции. Электролиз (продолжение)
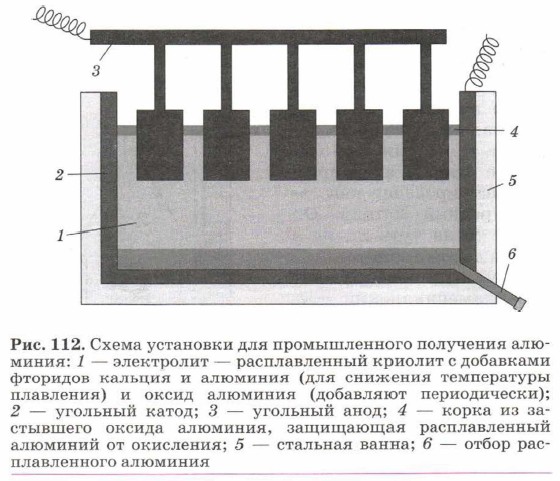
Немногим более ста лет назад американский студент-химик Ч. Холл и французский металлург П. Эру открыли, что обезвоженные бокситы (или глинозём — оксид алюминия (рис. 111)) можно растворить при 950 °С в расплавленном криолите и затем путём электролиза выделить из него алюминий (рис. 112). Метод Холла — Эру сделал возможным промышленное получение алюминия. Второй тип электролиза, используемого в промышленности, — это электролиз растворов. В этом процессе приходится учитывать не только те ионы, на которые диссоциирует электролит, но также и ионы, образующиеся при очень незначительной диссоциации молекул воды:
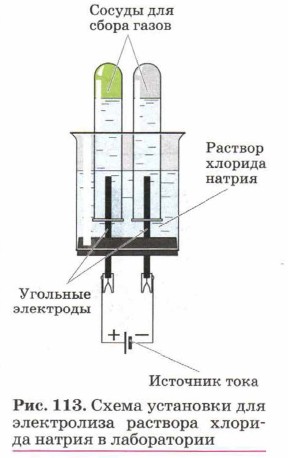
Рассмотрим электролиз раствора хлорида натрия (рис. 113). На катод в этом случае отправятся ионы Na+ и Н+, на анод — Сl- и ОН-. На катоде происходит восстановление катионов водорода, на аноде — окисление хлорид-анионов, а в растворе останутся катионы натрия и гидроксид-анионы. Суммарное уравнение рассмотренного процесса:
Следовательно, продуктами электролиза раствора хлорида натрия являются водород, хлор и гидроксид натрия. Для определения продуктов электролиза водных растворов электролитов существуют следующие правила. 1. Процесс на катоде зависит не от материала катода, из которого он сделан, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в начале ряда напряжений (по алюминий включительно), на катоде идёт процесс восстановления воды (выделяется водород Н2↑). Катионы металла не восстанавливаются, они остаются в растворе. 1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды. 1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла. 1.4. В растворе содержатся катионы разных металлов, то сначала востанавливается катион металла, стоящего в ряду напряжений правее.
|
|
|