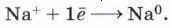|
|
|
|
|
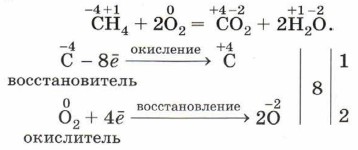
Глава вторая. Химические реакции § 19. Окислительно-восстановительные реакции. Электролиз (продолжение)Рассмотрим окислительно-восстановительную реакцию горения метана:
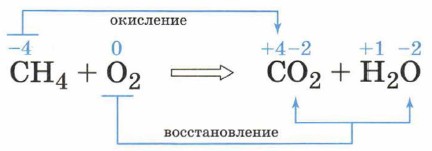
Этот процесс можно представить в виде схемы.
Наиболее сильными восстановителями являются металлы, водород, оксид углерода (II), углерод, сероводород, аммиак и др. Наиболее сильными окислителями являются фтор, кислород, озон, галогены, азотная и серная кислоты, перманганат калия и др. Однако самым сильным из известных окислителей и восстановителей является электрический ток. Он восстанавливает даже щелочные и щёлочноземельные металлы и алюминий из их соединений и окисляет даже ионы галогенов и кислорода из их соединений до простых веществ.
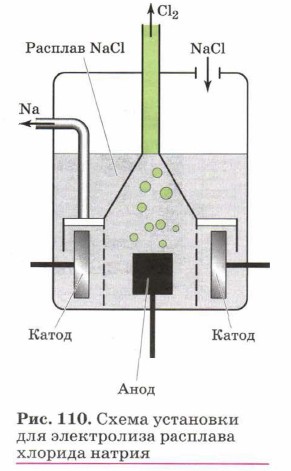
Знакомство с электролизом мы и начнём с электролиза расплавов электролитов. При плавлении электролиты распадаются на ионы, только в отличие от ионов в водных растворах такие ионы не гидратированы. При пропускании электрического тока через расплав ионы направляются к противоположно заряженным электродам и разряжаются на них. Рассмотрим электролиз расплава хлорида натрия. В расплаве эта соль диссоциирует: NaCl = Na+ + Сl-. Катионы натрия направляются к катоду (отрицательному полюсу источника тока) и разряжаются на нём, т. е. восстанавливаются:
Итоговое уравнение электролиза расплава хлорида натрия:
Схематично этот процесс представлен на рисунке 110. Именно так в промышленности получают щелочные и щёлочноземельные металлы, а также галогены. Впервые использовал электролиз для получения этих металлов английский химик Г. Дэви. Активные металлы получают не только из солей, но также и из расплавов других соединений, например оксидов. Так, мировая алюминиевая промышленность использует для производства этого металла обезвоженные бокситы. Оксид алюминия имеет атомную кристаллическую решётку и является чрезвычайно тугоплавким веществом. Поэтому получение из него алюминия изначально было очень дорогим. На Парижской выставке 1855 г. алюминий демонстрировался как самый редкий металл. Он стоил тогда чуть ли не в 10 раз дороже золота.
|
|
|