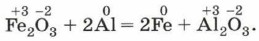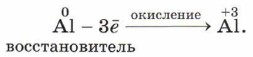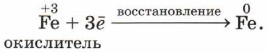|
|
|
|
|
Глава вторая. Химические реакции § 19. Окислительно-восстановительные реакции. ЭлектролизПовторим признаки, по которым классифицируют химические реакции: изменение состава веществ, число и состав реагентов и продуктов, фаза, тепловой эффект, направление, участие катализатора. Не менее значима классификация по признаку: «изменение степеней окисления элементов, образующих реагенты и продукты реакции». По этому признаку различают реакции, протекающие с изменением степени окисления (окислительно-восстановительные), и реакции, протекающие без изменения степени окисления. Степенью окисления называют условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что оно состоит только из простых ионов. Чтобы рассчитать степень окисления, нужно воспользоваться несложными правилами: 1) степень окисления (с. о.) кислорода почти всегда равна -2 (исключения: фторид кислорода 2) с. о. водорода почти всегда равна +1 (исключения: гидриды, например, 3) с. о. металлов всегда положительна, её максимальное значение почти всегда равно номеру группы; 4) с. о. свободных атомов и атомов в простых веществах всегда равна 0; 5) суммарная степень окисления атомов всех элементов в соединении равна 0.
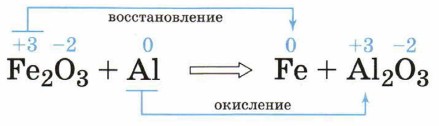
К окислительно-восстановительным относятся все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество. Почему эти реакции так называют? Рассмотрим примеры окислительно-восстановительных реакций с участием неорганических и органических веществ. В качестве первой реакции возьмём красивую и практически важную реакцию алюминотермии (см. рис. 99): Fe2O3 + 2Аl = 2Fe + Аl2O3. Обозначим степени окисления всех элементов в формулах веществ — реагентов и продуктов этой реакции:
Как видно из уравнения, два элемента — железо и алюминий — изменили свои степени окисления. Что с ними произошло? Алюминий из нейтрального атома превратился в условный ион в степени окисления +3, т. е. отдал три электрона:
Элементы или вещества, отдающие электроны, называют восстановителями. В ходе реакции они окисляются. Условный ион железа в степени окисления +3 получил три электрона и превратился в нейтральный атом:
Элементы или вещества, принимающие электроны, называют окислителями. В ходе реакции они восстанавливаются. Процессы, происходящие в рассмотренном примере, можно представить в виде схемы.
Понятие об окислительно-восстановительных реакциях универсально, т. е. оно справедливо не только для неорганической, но и для органической химии. Химики-органики употребляют аналогичные выражения, например, для альдегидов: «они восстанавливаются в спирты» или «они окисляются в кислоты».
|
|
|



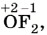 пероксиды, например,
пероксиды, например, 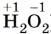 );
);
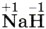 );
);