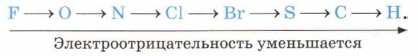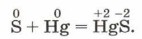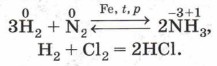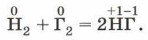|
|
|
|
|
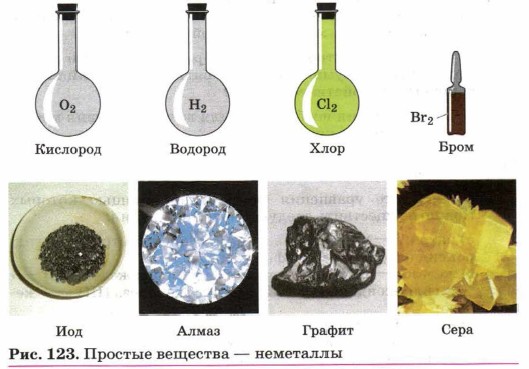
Глава третья. Вещества и их свойства § 21. НеметаллыОсобенности строения атомов неметаллов и их кристаллического строения мы уже рассматривали. Также вам хорошо знакомо и явление аллотропии, которое для элементов-неметаллов более характерно, чем для элементов-металлов. Среди физических свойств отметим лишь то, что, хотя по сравнению с металлами неметаллов гораздо меньше, для них трудно выделить общие физические свойства. Судите сами (рис. 123): водород, кислород, озон, фтор, хлор, азот — это газы при обычных условиях, бром — жидкость, а бор, углерод (все аллотропные модификации), кремний, сера, фосфор, селен, теллур, иод, астат — твёрдые вещества. Окраска неметаллов — простых веществ охватывает все цвета спектра: красный (красный фосфор, красно-бурый бром), жёлтый (сера), зелёный (жёлто-зелёный хлор), фиолетовый (иод) и т. д.
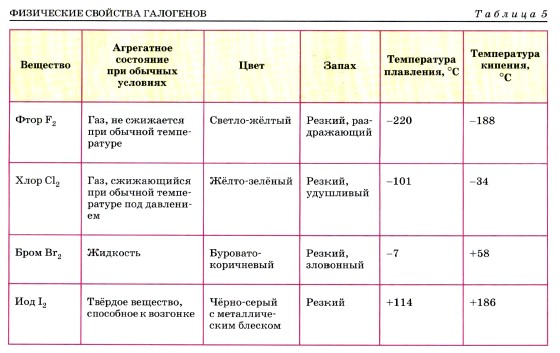
Температуры плавления неметаллов также лежат в очень широком интервале — от 3800 °С у графита до -210 °С у азота, что, как вы знаете, является следствием образования ими двух типов кристаллических решёток: молекулярной и атомной (вспомните особенности этих типов решёток и свойства, определяемые ими, приведите примеры). Для галогенов можно проследить изменение физических свойств неметаллов в зависимости от их положения в Периодической системе (табл. 5). Если химические свойства металлов характеризуются как восстановительные, то для неметаллов характерны и восстановительные, и окислительные свойства. Способность неметаллов проявлять те или другие свойства определяется их положением в ряду электроотрицательности:
Окислительные свойства неметалловНаиболее ярко окислительные свойства неметаллов проявляются в реакциях с металлами, о чём подробно говорилось в предыдущем параграфе. Например, даже малоактивная ртуть при обычных условиях соединяется с серой:
Эту реакцию используют для сбора пролитой ртути, которая чрезвычайно ядовита. Этот процесс называют демеркуризацией (в Средние века каждый металл считался представителем того или иного небесного тела на Земле; ртуть связывали с Меркурием). Окислительные свойства неметаллы проявляют и по отношению к водороду (почему?). Многие реакции синтеза водородных соединений неметаллов имеют большое практическое значение. Так, например, получают в промышленности аммиак и хлороводород:
На примере взаимодействия галогенов с водородом рассмотрим зависимость скорости химической реакции от природы галогена. Обозначив галоген символом Г, уравнение этой реакции можно записать так:
Так, если фтор взаимодействует с водородом со взрывом почти при любых условиях, то хлор взрывается только на свету, бром взаимодействует с водородом без взрыва, а твёрдый иод вступает не в экзотермическое, как первые три галогена, а в эндотермическое взаимодействие. На примере водорода вы смогли убедиться, что неметаллы (ведь водород тоже неметалл) способны проявлять и восстановительные свойства. Всё зависит от положения неметалла в ряду электроотрицательности. Например, фосфор, менее электроотрицательный элемент, будет проявлять восстановительные свойства по отношению к более электроотрицательному хлору:
|
|
|