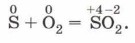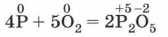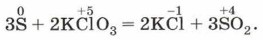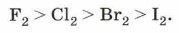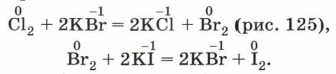|
|
|
|
|
Глава третья. Вещества и их свойства § 21. Неметаллы (окончание)Восстановительные свойства неметалловИсходя из значений электроотрицательности, можно предположить, что по отношению к фтору и кислороду остальные неметаллы всегда будут проявлять восстановительные свойства. Наиболее известны и значимы реакции горения неметаллов с участием кислорода (рис. 124, а), например:
Как вы знаете, эта реакция является первой стадией процесса получения серной кислоты из серы (запишите уравнения реакций для двух остальных). Аналогично, горение фосфора в кислороде:
(рис. 124, б) — это первая стадия получения фосфорной кислоты. Восстановительные свойства неметаллы проявляют также и в реакциях со сложными веществами — сильными окислителями. Например, реакция серы и фосфора с бертолетовой солью лежит в основе зажигания обыкновенной спички:
Окислительно-восстановительные свойства галогенов характеризуются своеобразным рядом активности:
Например:
Фтор, как и щелочные металлы, для реакций с растворами солей непригоден, так как реагирует с водой — вода горит во фторе (запишите уравнение реакции).
1. Какими особенностями строения отличаются атомы и кристаллы неметаллов? Как их строение определяет свойства этого класса веществ? Какие свойства — окислительные или восстановительные — характерны для неметаллов? 2. Что такое электроотрицательность? Сравните ряд электроотрицательности неметаллов с электрохимическим рядом напряжений металлов. 3. Охарактеризуйте окислительные свойства неметаллов, запишите соответствующие уравнения реакций. Каким кристаллическим строением и свойствами обладают продукты реакций металлов с неметаллами? Приведите примеры. 4. Охарактеризуйте восстановительные свойства неметаллов, запишите соответствующие уравнения реакций. 5. Каким кристаллическим строением и какими свойствами будут обладать летучие водородные соединения неметаллов? 6. Взаимодействие красного фосфора с бертолетовой солью описывается следующей схемой: Р + КСlO3 → Р2O5 + КСl. Составьте уравнение этой реакции, расставив коэффициенты в нём методом электронного баланса. Укажите окислитель и восстановитель. 7. Взаимодействие фосфора с азотной кислотой описывается следующей схемой: Р + HNO3 + Н2O → Н3РO4 + NO. Составьте уравнение этой реакции, расставив коэффициенты в нём методом электронного баланса. Укажите окислитель и восстановитель. 8. Подготовьте презентацию (по выбору) об областях применения серы, фосфора, хлора, углерода, азота.
|
|
|