|
|
|
|
|
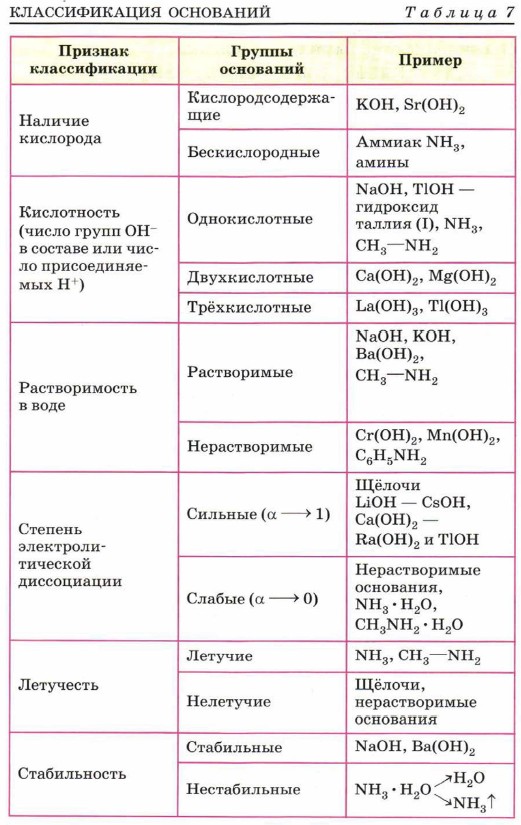
Глава третья. Вещества и их свойства § 23. ОснованияКлассификацию оснований (дайте определение этого понятия с точки зрения состава и продуктов диссоциации) можно провести по тем же признакам, что и классификацию кислот (табл. 7). Водные растворы щелочей, мылкие на ощупь, разъедают кожу, ткань, изменяют окраску индикаторов. Нерастворимые основания этими свойствами не обладают. Взаимодействие с кислотамиОбъединяет все группы оснований их общее свойство — это взаимодействие с кислотами с образованием солей. Эту реакцию дают как кислородные основания (и щёлочи, и нерастворимые основания), так и бескислородные основания (аммиак, амины). Реакцию нейтрализации между щёлочью и кислотой мы уже рассмотрели в предыдущем параграфе: Ва(ОН)2 + 2СН3СООН → (СН3СОО)2Ва + 2Н2O,
Также в предыдущем параграфе мы познакомились со взаимодействием кислот с нерастворимыми основаниями и амфотерными гидроксидами: Fe(OH)3 + ЗНСl = FeCl3 + 3H2O,
Бескислородные основания при взаимодействии с кислотами, в отличие от кислородных, образуют только соли: NH3 + НСl = NH4Cl,
Взаимодействие с кислотными оксидамиЭто свойство характерно для щелочей. Например, для обнаружения углекислого газа используют в роли реактива известковую воду, и, наоборот, для распознавания раствора гидроксида кальция в роли реактива выступает углекислый газ. В обоих случаях происходит одна и та же качественная реакция: Са(ОН)2 + СO2 = СаСO3↓ + Н2O,
|
|
|