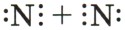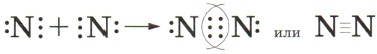|
|
|
|
|
Глава первая. Атомы химических элементов Взаимодействие атомов элементов-неметаллов между собойВ заключение рассмотрим алгоритм рассуждений, необходимых для того, чтобы записать схему образования ковалентной связи, например для молекулы азота N2. 1. Азот — это элемент главной подгруппы V группы (VA группы). Его атомы имеют по пять электронов на внешнем уровне. Чтобы определить число неспаренных электронов, воспользуемся формулой: 8 - N = число неспаренных электронов, где N — номер группы химического элемента. Следовательно, атомы азота будут иметь (8 - 5 = 3) три неспаренных электрона. 2. Запишем знаки химических элементов с обозначением внешних электронов так, чтобы неспаренные электроны были обращены к соседнему знаку:
3. Запишем электронную и структурную формулы образовавшейся молекулы:
Если атомы связаны между собой одной общей электронной парой, то такую ковалентную связь называют одинарной, если двумя — двойной, если тремя — тройной. Чем больше общих электронных пар у атомов в молекуле, тем прочнее связаны они друг с другом и тем меньше расстояние между ядрами атомов, которое называют длиной связи. В молекулах фтора связь одинарная, и длина связи между ядрами атомов составляет 0,14 нанометра (1 нм = 10-9 м, или 0,000000001 м). В молекулах азота связь тройная, и длина её составляет 0,11 нм. Чтобы разделить молекулу азота на отдельные атомы, необходимо затратить примерно в семь раз больше энергии, чем для разрыва одинарных связей в молекуле фтора.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Все элементы главной подгруппы VII группы (VIIA группы) Периодической системы Д. И. Менделеева (подгруппы фтора) образуют простые вещества, состоящие из двухатомных молекул. Запишите электронную схему образования и структурную формулу таких молекул, пользуясь общим химическим знаком для всей подгруппы Г (галоген). 2. Запишите схемы образования химических связей для веществ, состав которых отображают формулами КСl и С12. 3. Сколько неспаренных электронов имеют атомы серы? Какая связь будет в молекулах S2? Запишите схему образования химической связи в молекулах S2. 4. Расположите в порядке увеличения прочности химической связи вещества с формулами S2, Cl2, N2 и обоснуйте правильность своего решения. Как будет изменяться длина связи в молекулах составленного вами ряда? 5. Разделите вещества на две группы по типу химической связи: N2, Li2О, КСl, О2, CaF2, Н2. <<< К началу Ответы к § 11 >>>
|
|
|