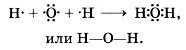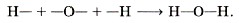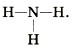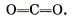|
|
|
|
|
Глава первая. Атомы химических элементов Ковалентная полярная химическая связь2. Запишем знаки химических элементов с обозначением внешних электронов:
3. Запишем электронную и структурную формулы образовавшихся молекул:
4. По ряду ЭО определим, что общие электронные пары будут смещены от кислорода к фтору, как к более электроотрицательному элементу, т. е. связь будет ковалентной полярной: Аналогично образуются молекулы воды:
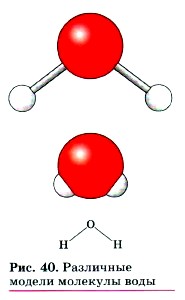
В действительности молекула воды имеет не линейную, а угловую форму (∠HOH = 104°27’). Строение молекулы воды можно изобразить различными способами (рис. 40).
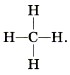
Атом водорода образует только одну ковалентную связь с другими атомами. Поэтому говорят, что водород одновалентен. Атом кислорода связан с другими атомами двумя химическими связями — он двухвалентен. При образовании молекул атомы соединяются таким об разом, чтобы все их валентности были задействованы. Понятно, что двухвалентный кислород должен соединиться с двумя атомами одновалентного водорода. Если обозначить валентность чёрточкой, то схему образова ния молекулы воды можно представить так:
Аналогично трёхвалентный азот соединяется с тремя атомами одновалентного водорода в молекулу аммиака
Формулы, в которых валентности элементов обозна чены чёрточками, как вы знаете, называют структурными. Структурная формула метана СН4 — соединение четырёхвалентного углерода с водородом — будет следующей:
А каким образом соединяются в молекулу углекислого газа С02 атомы четырёхвалентного углерода и двухвалентного кислорода? Очевидно, этот способ может отразить только следующая структурная формула:
Является ли валентность постоянной величиной? Оказывается для водорода и кислорода это утверждение верно, а вот для азота и углерода нет, так как эти элементы могут проявлять и другие значения валентности. Например, азот может быть одно-, двух-, трёх-, четырёхвалентен. Его соединения с кислородом будут иметь разный состав. Следовательно, различают:
|
|
|



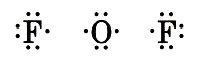
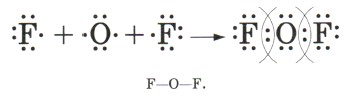
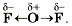 .
.