|
|
|
|
|
Глава первая. Атомы химических элементов § 12. Ковалентная полярная химическая связьПри взаимодействии двух атомов одного и того же элемента-неметалла между ними образуется ковалентная химическая связь с помощью общих электронных пар. Эту ковалентную связь называют неполярной, так как общие электронные пары принадлежат обоим атомам в одинаковой степени и ни на одном из них не будет избытка или недостатка отрицательного заряда, который несут электроны. Однако если ковалентная связь образуется между атомами разных элементов-неметаллов, то картина будет несколько иной. Рассмотрим, например, образование молекулы хлороводорода НСl из атомов водорода и хлора. 1. Атом водорода имеет на единственном уровне один электрон, и до его завершения ему не хватает ещё одного электрона. У атома хлора на внешнем уровне — семь электронов, и ему также недостает до завершения одного электрона. 2. Атомы водорода и хлора объединяют свои непарные электроны и образуют одну общую электронную пару, т. е. возникает ковалентная связь:
Структурная формула молекулы хлороводорода Н-Сl. 3. Так как ковалентная связь образуется между атомами различных элементов-неметаллов, то общая электронная пара будет принадлежать взаимодействующим атомам уже не в равной степени. Для того чтобы качественно определить, какому из этих атомов общая электронная пара будет принадлежать в большей мере, используют понятие электроотрицательноcть.
ЭО можно охарактеризовать как меру неметалличности химических элементов. В порядке уменьшения ЭО химические элементы располагаются в следующий ряд:
Самый электроотрицательный элемент в таблице Д. И. Менделеева — фтор. Это, так сказать, «золотой призёр» электроотрицательности. «Серебряным призёром» является кислород, а «бронзовым» — азот. Величина ЭО элемента зависит от его положения в таблице Д. И. Менделеева: в каждом периоде она обычно возрастает с увеличением порядкового номера элемента, а в каждой подгруппе — уменьшается. Пользуясь рядом ЭО, можно определить, куда смещаются общие электронные пары. Они всегда смещены к атомам элемента с большей ЭО. Например, в молекуле хлороводорода НСl общая электронная пара смещена к атому хлора, так как его ЭО больше, чем у водорода. В результате на атомах образуются частичные заряды Н+0,18Сl-0,18; в молекуле возникают два полюса — положительный и отрицательный. Поэтому такую ковалентную связь называют полярной. Смещение общих электронных пар в случае ковалентной полярной связи иногда обозначают стрелками, а частичный заряд — греческой буквой δ («дельта»): В формулах соединений химический знак менее электроотрицательного элемента пишут первым. Так как ковалентная полярная связь является разновидностью ковалентной связи, то алгоритм рассуждений для её схематического изображения такой же, как и для ковалентной неполярной связи (см. § 11), только в этом случае добавится ещё один шаг — четвёртый: по ряду ЭО определим более электроотрицательный элемент и отразим полярность связи в структурной формуле стрелкой и обозначением частичных зарядов. Например, рассмотрим алгоритм схематического изображения образования связи для соединения OF2 — фторида кислорода. 1. Кислород — это элемент главной подгруппы VI группы (VIA группы) Периодической системы Д. И. Менделеева. Его атомы имеют по шесть электронов на внешнем электронном слое. Непарных электронов будет: 8 - 6 = 2. Фтор — элемент главной подгруппы VII группы (VIIA группы) Периодической системы Д. И. Менделеева. Его атомы содержат по семь электронов на внешнем электронном слое. Непарным является один электрон.
|
|
|



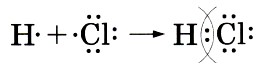


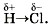 .
.