|
|
|
|
|
Глава третья. Соединения химических элементов § 18. Степень окисления (окончание)Нетрудно заметить, что аналогично вы работали с понятием «валентность», когда выводили формулу ковалентного соединения или определяли валентность элемента по формуле его соединения. Названия бинарных соединений образуют из двух слов — названий входящих в их состав химических элементов. Первое слово обозначает электроотрицательную часть соединения — неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть — металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже:
Например: NaCl — хлорид натрия, MgS — сульфид магния, КН — гидрид калия, СаО — оксид кальция. Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которую ставят в конце названия, например: Если соединение состоит из двух элементов-неметаллов, то к названию более электроотрицательного из них прибавляют суффикс -ид, второй компонент ставится после этого в родительном падеже. Например: В некоторых случаях число атомов элементов обозначают при помощи названий числительных на греческом языке — моно, ди, три, тетра, пента, гекса и т. д. Например: Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А. Фуркруа, Л. Гитоном де Мерво и К. Бертолле в 1785 г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность учёных разных стран и издаёт рекомендации по номенклатуре веществ и терминологии, используемой в химии.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Запишите формулы оксидов азота (II), (V), (I), (III), (IV). 2. Дайте названия бинарных соединений, формулы которых: а) Сl2О7, Сl20, СlО2; б) FeCl2, FeCl3; в) MnS, MnО2, MnF4, МnО, МnСl4; г) Cu2О, Mg2Si, SiCl4, Na3N, FeS. 3. Найдите по справочникам и словарям всевозможные названия веществ с формулами: а) СО2 и СО; б) SO2 и SО3. Объясните их этимологию. Дайте по два названия этих веществ помеждународной номенклатуре в соответствии с правилами, изложенными в параграфе. 4. Какое ещё название можно дать аммиаку H3N? 5. Найдите объём, который имеют при н. у. 17 г сероводорода. Сколько молекул его содержится в этом объёме? 6. Вычислите массу 33,6 м3 метана СН4 при н. у. и определите число его молекул, содержащееся в этом объёме. 7. Определите степень окисления углерода и запишите структурные формулы следующих веществ, зная, что углерод в органических соединениях всегда четырёхвалентен: метана СН4, тетрахлорметана ССl4, этана С2Н4, ацетилена С2Н2. <<< К началу Ответы к § 18 >>>
|
|
|



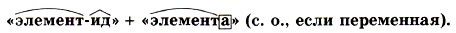
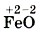 — оксид железа (II) (читают «оксид железа два»),
— оксид железа (II) (читают «оксид железа два»), 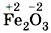 — оксид железа (III) (читают «оксид железа три»).
— оксид железа (III) (читают «оксид железа три»).
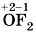 — фторид кислорода (II),
— фторид кислорода (II), 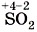 — оксид серы (IV) и
— оксид серы (IV) и 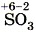 — оксид серы (VI).
— оксид серы (VI).
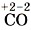 — монооксид углерода, или оксид углерода (II),
— монооксид углерода, или оксид углерода (II), 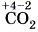 — диоксид углерода, или оксид углерода (IV),
— диоксид углерода, или оксид углерода (IV), 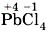 — тетрахлорид свинца, или хлорид свинца (IV).
— тетрахлорид свинца, или хлорид свинца (IV).

