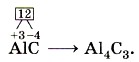|
|
|
|
|
Глава третья. Соединения химических элементов Степень окисленияК понятию «степень окисления» близко понятие «валентность», с которым вы знакомились, рассматривая ковалентную химическую связь. Однако это не одно и то же. Понятие «валентность» применимо для веществ, имеющих молекулярное строение. Подавляющее большинство органических веществ, с которыми вы будете знакомиться в 10 классе, имеет именно такое строение. В курсе основной школы вы изучаете неорганическую химию, предметом которой являются вещества как молекулярного, так и немолекулярного, например ионного, строения. Поэтому предпочтительнее использовать понятие «степень окисления». Чем же отличается валентность от степени окисления? Часто валентность и степень окисления численно совпадают, но валентность не имеет знака заряда, а степень окисления — имеет. Например, одновалентный водород имеет следующие степени окисления в различных веществах:
Казалось бы, что одновалентный фтор — самый электроотрицательный элемент — должен иметь полное совпадение значений степени окисления и валентности.Ведь его атом способен образовывать лишь одну-единственную ковалентную связь, так как ему недостаёт до завершения внешнего электронного слоя одного электрона. Однако и здесь наблюдается различие:
Ещё более различаются между собой валентность и степень окисления, если они численно не совпадают. Например: • в пероксиде водорода
• в серном колчедане
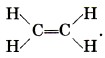
• в этилене
В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, можно найти степень окисления другого элемента по формуле, например бинарного соединения. Так, найдём степень окисления хлора в соединении Обозначим степень окисления кислорода: Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). 1. Запишем знаки алюминия и углерода рядом АlС, причём сначала — знак алюминия, так как это металл, т. е. менее электроотрицательный элемент. 2. Определим по Периодической системе Д. И. Менделеева число внешних электронов: у Аl — три электрона, у С — четыре. Атом алюминия отдаст свои три внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до заветной восьмёрки четыре электрона и получит при этом степень окисления -4. 3. Запишем эти значения в формулу 4. Найдём наименьшее общее кратное (НОК) для них, оно равно 12. Затем рассчитаем индексы, разделив НОК на соответствующие значения степеней окисления,
|
|
|



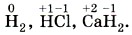
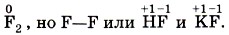
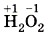 степень окисления кислорода равна - 1 , а валентность равна II:
степень окисления кислорода равна - 1 , а валентность равна II:
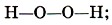
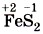 степень окисления серы равна - 1 , а валентность — II:
степень окисления серы равна - 1 , а валентность — II:
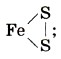
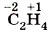 степень окисления углерода равна - 2 , а валентность — IV:
степень окисления углерода равна - 2 , а валентность — IV:
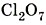 .
.
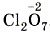 . Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) × 7 = -14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора: (+14) : 2 = +7. Следовательно, степень окисления хлора равна +7:
. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) × 7 = -14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора: (+14) : 2 = +7. Следовательно, степень окисления хлора равна +7: 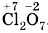 .
.
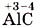 .
.