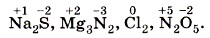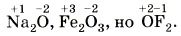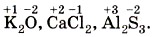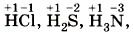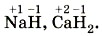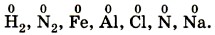|
|
|
|
|
Глава третья. Соединения химических элементов § 18. Степень окисленияПри изучении ионной и ковалентной полярной химических связей вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют бинарными (от лат. би — два) или двухэлементными. Вспомним типичные бинарные соединения, которые мы приводили в качестве примера для рассмотрения механизмов образования ионной и ковалентной полярной химической связи: NaCl — хлорид натрия и НСl — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом +1, а атом хлора принял электрон и превратился в ион с зарядом - 1 . Схематически процесс превращения атомов в ионы можно изобразить так:
В молекуле же хлороводорода НСl химическая связь образуется за счёт спаривания неспаренных внешних электронов и образования общей электронной пары атомов водорода и хлора:
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным р-облаком атома хлора:
При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора:
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т. е. атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления —1 во всех соединениях. Кислород, второй после фтора по значению электроотрицательности элемент, почти всегда имеет степень окисления - 2 , кроме соединений со фтором, например:
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т. е. атомы менее электроотрицательных элементов. Металлы в соединениях всегда имеют положительную степень окисления. У металлов главных подгрупп: I группы (IA группы) во всех соединениях степень окисления равна +1, II группы (IIA группы) равна +2, III группы (IIIA группы) — +3, например:
В большинстве соединений атомы водорода имеют степень окисления +1, например:
но в соединениях с металлами у водорода степень окисления —1:
Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии, например:
|
|
|



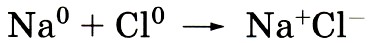
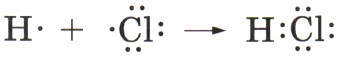
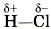 , т. е. электрон не полностью перейдёт от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов δ (см. § 12): Н+0,18Сl-0,18. Если же представить, что и в молекуле хлороводорода НСl, как и в хлориде натрия NaCl, электрон полностью перешёл от атома водорода к атому хлора, то они получили бы заряды +1 и - 1 :
, т. е. электрон не полностью перейдёт от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов δ (см. § 12): Н+0,18Сl-0,18. Если же представить, что и в молекуле хлороводорода НСl, как и в хлориде натрия NaCl, электрон полностью перешёл от атома водорода к атому хлора, то они получили бы заряды +1 и - 1 : 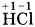 . Такие условные заряды называют степенью окисления. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
. Такие условные заряды называют степенью окисления. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.