|
|
|
|
|
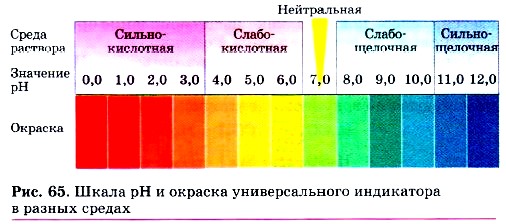
Глава третья. Соединения химических элементов § 21. Кислоты (окончание)Добавим к растворам кислот по нескольку капель раствора лакмуса фиолетового цвета. Лакмус окрасится в красный цвет. Метиловый оранжевый при действии кислот изменяет оранжевый цвет на красно-розовый (см. табл. 4 в § 20). А вот кремниевую кислоту H2SiO3, поскольку она нерастворима в воде, так распознавать нельзя. Кроме этих индикаторов химики используют множество других, в том числе и смеси различных индикаторов. Наиболее удобен универсальный индикатор, который представляет собой смесь индикаторов, нанесённую на специальные бумажные полоски. Изменение цвета при помещении такой полоски в испытуемый раствор сигнализирует не только о том, является ли среда раствора нейтральной, щелочной или кислотной, но также и о том, насколько значительны его кислотность или щёлочность, которые оцениваются по специальной шкале (рис. 65). Эта шкала нанесена на упаковку полосок универсальной индикаторной бумаги. Она называется шкалой рН (читается «пэ-аш»). Значение рН нейтральной среды (например, дистиллированной воды) равно 7,0 (рН = 7,0). В кислотной среде рН меньше 7,0 (рН < 7,0), и чем меньше эта величина, тем выше кислотность раствора. В щелочной среде рН больше 7,0 (рН > 7,0), и чем больше эта величина, тем выше щёлочность раствора. Изменение цвета полоски, помещённой в испытуемый раствор, затем сравнивают со шкалой.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Дайте характеристику фосфорной кислоты по плану: а) формула; б) наличие кислорода; в) основность; г) растворимость; д) степени окисления элементов, образующих кислоту; е) заряд иона, образуемого кислотным остатком; ж) соответствующий оксид. 2. Почему нельзя приливать воду в серную кислоту для её разбавления? 3. Составьте химические формулы кислот, соответствующих оксидам, формулы которых: N2O3, СO2, SiO2, SO2. Дайте названия всех веществ. 4. Вычислите количество вещества, соответствующее: а) 490 г серной кислоты H2SO4; б) 9,8 г фосфорной кислоты Н3РO4. <<< К началу Ответы к § 21 >>>
|
|
|