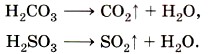|
|
|
|
|
Глава третья. Соединения химических элементов КислотыБинарные бескислородные кислоты НСl и H2S образуют в водных растворах простые ионы Сl- и S2- , а кислородсодержащие кислоты образуют сложные ионы, например NO-3 и Для того чтобы различать степени окисления и заряды ионов, условились записывать знак «+» или «-» перед цифрой, указывающей величину заряда степени окисления1: 1 Степень окисления записывают над символом элемента. 2 Заряд иона записывают справа от символа химического элемента.
Познакомимся с некоторыми из кислот. В природе встречается много кислот: лимонная кислота в лимонах, яблочная кислота в яблоках, щавелевая кислота в листьях щавеля, муравьиная кислота в пчелином яде и жгучих волосках крапивы (рис. 62). Муравьи защищаются от врагов, разбрызгивая едкие капельки, содержащие муравьиную кислоту. При скисании виноградного сока получается уксусная кислота, а при скисании молока — молочная кислота (рис. 63). Она же образуется при квашении капусты и при силосовании кормов для скота. В быту часто применяют лимонную и уксусную кислоты. Употребляемый в пищу уксус — это раствор уксусной кислоты. Многие кислоты, например серная и соляная, нужны в народном хозяйстве в огромных количествах.
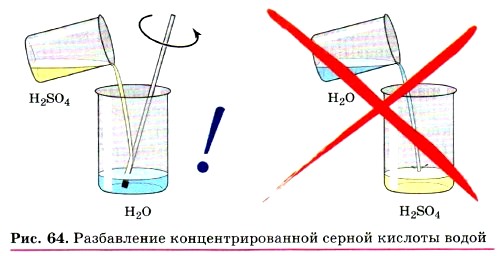
Серная кислота H2SO4 — бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота поглощает влагу из воздуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов. При смешивании серной кислоты с водой выделяется большое количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего. Чтобы этого не случилось, при растворении серной кислоты нужно вливать её тонкой струей в воду и перемешивать (рис. 64). Серная кислота обугливает древесину, кожу, ткани. Если в пробирку с серной кислотой опустить лучинку, то происходит химическая реакция — лучинка обугливается. Теперь понятно, как опасно попадание брызг серной кислоты на кожу человека и одежду. Угольная и сернистая кислоты — Н2СO3 и H2SO3 — в свободном виде не существуют, так как они разлагаются на воду и соответствующий оксид (газ):
Растворы всех кислот кислые, но распознавать концентрированные кислоты на вкус не решится ни один химик — это опасно. Есть более эффективные и безопасные способы обнаружения кислот. Их так же, как и щёлочи, распознают с помощью индикаторов.
|
|
|



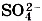 .
.
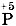 , но после цифры, указывающей величину заряда иона2:
, но после цифры, указывающей величину заряда иона2: 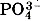 . И ещё: единичный заряд степени окисления обозначают цифрой +1 или - 1 , а единичный заряд иона — только знаками «+» или «-». Например, степень окисления
. И ещё: единичный заряд степени окисления обозначают цифрой +1 или - 1 , а единичный заряд иона — только знаками «+» или «-». Например, степень окисления 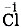 , а заряд иона Сl -.
, а заряд иона Сl -.