|
|
|
|
|
Глава третья. Соединения химических элементов § 21. КислотыС одним из представителей веществ этого класса вы уже познакомились, когда рассматривали летучие водородные соединения на примере хлороводорода НСl. Раствор его в воде и представляет собой соляную кислоту. Она имеет ту же формулу НСl. Аналогично при растворении в воде другого летучего водородного соединения — сероводорода H2S — образуется раствор сероводородной кислоты с формулой H2S. Молекулы этих кислот состоят из двух элементов, т. е. они являются бинарными соединениями. Однако к классу кислот относят также и соединения, состоящие из большего числа химических элементов. Как правило, третьим элементом, входящим в состав кислоты, является кислород. Поэтому такие кислоты называют кислородсодержащими, в отличие от НСl и H2S, которые называют бескислородными. Перечислим некоторые кислородсодержащие кислоты. Азотная кислота — HNO3. Азотистая кислота — HNO2. Серная кислота — H2SO4. Сернистая кислота — H2SO3. Угольная кислота — Н2СO3. Кремниевая кислота — H2SiO3. Фосфорная кислота — Н3РO4. Обратите внимание, что все кислоты (и кислородсодержащие, и бескислородные) обязательно содержат водород, который в формуле записывают на первом месте. Всю остальную часть формулы называют кислотным остатком. Например, у НСl кислотным остатком является Сl, а у Н3РO4 кислотный остаток РO4.
Как правило, кислотные остатки образуют элементы-неметаллы. По формулам кислот можно определить степени окисления атомов химических элементов, образующих кислоты. Для бинарных кислот это сделать просто. Так как у водорода степень окисления +1, то в соединении Несложно будет рассчитать и степени окисления атомов элементов-неметаллов, образующих кислотные остатки кислородсодержащих кислот. Нужно только помнить, что суммарная степень окисления атомов всех элементов в соединении равна нулю, а степени окисления водорода +1 и кислорода - 2 . Тогда, например, по формуле серной кислоты
где х — степень окисления серы, откуда х = +6. Отсюда формула серной кислоты с проставленными степенями окисления принимает вид Зная степень окисления элемента-неметалла, образующего кислотный остаток кислородсодержащей кислоты, можно определить, какой оксид ей соответствует. Например, серной кислоте По формулам кислот можно также определить и общий заряд, который имеют кислотные остатки. Заряд кислотного остатка всегда отрицателен и равен числу атомов водорода в кислоте. Число атомов водорода в кислоте называют основностью. Для одноосновных кислот, содержащих один атом водорода, например НСl и HNO3, заряды ионов кислотных остатков, которые они образуют в растворе, равны 1 - , т. е. Сl- и NO-3 . Для двухосновных кислот, например H2SO4 и H2S, заряды кислотных остатков равны 2-, т. е.
|
|
|




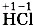 у хлора степень окисления -1, а в соединении
у хлора степень окисления -1, а в соединении 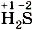 у серы степень окисления - 2 .
у серы степень окисления - 2 .
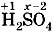 можно составить уравнение:
можно составить уравнение:
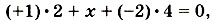
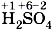 .
.
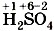 , в которой у серы степень окисления равна +6, соответствует оксид серы (VI)
, в которой у серы степень окисления равна +6, соответствует оксид серы (VI) 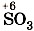 ; азотной кислоте
; азотной кислоте 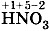 , в которой у азота степень окисления равна +5, соответствует оксид азота (V)
, в которой у азота степень окисления равна +5, соответствует оксид азота (V) 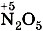 .
.
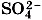 и S2- . Кислотный остаток, например
и S2- . Кислотный остаток, например 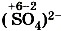 - , имеет общий заряд 2 - и представляет собой сложный ион, который образуется при растворении кислоты в воде.
- , имеет общий заряд 2 - и представляет собой сложный ион, который образуется при растворении кислоты в воде.