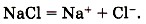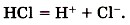|
|
|
|
|
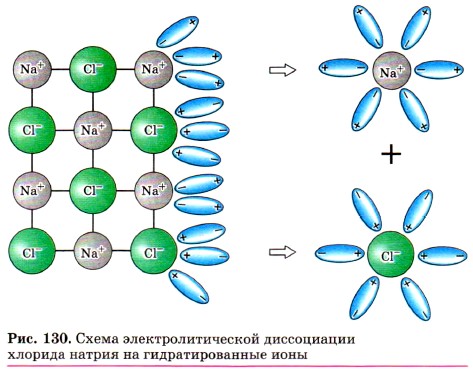
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции Электролитическая диссоциацияКак правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решёткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита (рис. 130).
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате химическая связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), будет такой: 1) ориентация молекул — диполей воды около ионов кристалла; 2) гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла; 3) диссоциация (распад) кристалла электролита на гидратированные ионы. Упрощённо происходящие процессы можно отразить с помощью следующего уравнения:
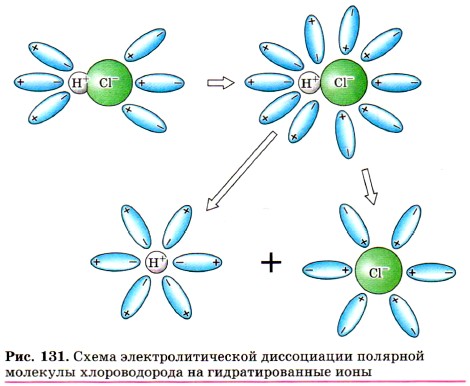
Аналогично диссоциируют и электролиты, в молекулах которых ковалентная полярная связь (например, молекулы хлороводорода НСl, рис. 131), только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную, и последовательность процессов, происходящих при этом, будет такая:
1) ориентация молекул воды вокруг полюсов молекулы электролита; 2) гидратация (взаимодействие) молекул воды с молекулами электролита; 3) ионизация молекул электролита (превращение ковалентной полярной связи в ионную); 4) диссоциация (распад) молекул электролита на гидратированные ионы. Уравнение диссоциации соляной кислоты:
В растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и объединиться. Этот обратный процесс называют ассоциацией.
|
|
|