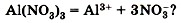|
|
|
|
|
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции Основные положения теории электролитической диссоциацииДля многоосновных кислот протекает ступенчатая диссоциация. Например, для фосфорной кислоты Н3РO4: 1-я ступень — образование дигидрофосфат-ионов:
2-я ступень — образование гидрофосфат-ионов:
Следует учитывать, что диссоциация электролитов по второй ступени происходит намного слабее, чем по первой. Диссоциация по третьей ступени при обычных условиях почти не происходит. Все кислоты объединяет то, что они при диссоциации обязательно образуют катионы водорода. Поэтому логично предположить, что общие характерные свойства кислот — кислый вкус, изменение окраски индикаторов и др. — обусловлены именно катионами водорода.
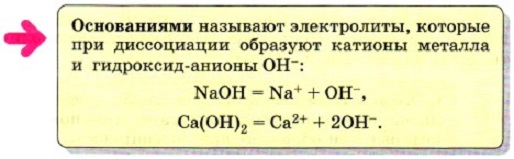
Все общие свойства оснований — мылкость на ощупь, изменение окраски индикаторов и др. — обусловлены общими для всех оснований гидроксид-ионами ОН-.
Очевидно, что свойства солей определяются как катионами металла, так и анионами кислотного остатка. Так, соли аммония имеют как общие свойства, обусловленные ионами
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Сравните по строению и свойствам:
2. Используя таблицу растворимости, приведите примеры пяти веществ, которые в растворах образуют сульфат-ионы 3. Какую информацию несёт в себе следующее уравнение:
Дайте названия вещества и ионов. 4. Запишите уравнения диссоциации: сульфата железа (III), карбоната калия, фосфата аммония, нитрата меди (II), гидроксида бария, соляной кислоты, гидроксида калия, хлорида железа (II). Дайте названия ионов. 5. Какие из перечисленных ниже веществ будут диссоциировать: гидроксид железа (II), гидроксид калия, кремниевая кислота, азотная кислота, оксид серы (IV), оксид кремния (IV), сульфид натрия, сульфид железа (II), серная кислота? Почему? Запишите возможные уравнения диссоциации. 6. В записи уравнений ступенчатой диссоциации серной кислоты для первой ступени используют знак равенства, а для второй — знак обратимости. Почему? <<< К началу Ответы к § 37 >>>
|
|
|



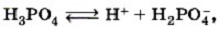
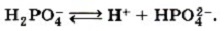

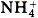 , так и специфические, обусловленные различными анионами. Аналогично, общие свойства сульфатов — солей серной кислоты — определяются ионами
, так и специфические, обусловленные различными анионами. Аналогично, общие свойства сульфатов — солей серной кислоты — определяются ионами 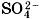 , а различные — разными катионами. В отличие от многоосновных кислот и оснований, содержащих несколько гидроксид-ионов, такие соли, как K2SO4, Al2(SO4)3 И Т. Д., диссоциируют сразу полностью, а не ступенчато:
, а различные — разными катионами. В отличие от многоосновных кислот и оснований, содержащих несколько гидроксид-ионов, такие соли, как K2SO4, Al2(SO4)3 И Т. Д., диссоциируют сразу полностью, а не ступенчато:


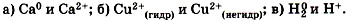
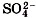 . Запишите уравнения электролитической диссоциации этих веществ.
. Запишите уравнения электролитической диссоциации этих веществ.