|
|
|
|
|
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции § 37. Основные положения теории электролитической диссоциацииОбобщим сведения об электролитической диссоциации в виде основных положений ныне общепризнанной теории. Она заключается в следующем.
Ионы — это одна из форм существования химического элемента. Свойства ионов совершенно не похожи на свойства атомов, которые их образовали. Например, атомы металла натрия Na0 энергично взаимодействуют с водой, образуя при этом щёлочь (NaOH) и водород Н2, в то время как ионы натрия Na+ таких продуктов не образуют. Хлор Сl2 имеет жёлто-зелёный цвет и резкий запах, ядовит, а ионы хлора Сl- бесцветны, неядовиты, лишены запаха. Никому не придёт в голову использовать в пищу металлический натрий и газообразный хлор, в то время как без хлорида натрия, состоящего из ионов натрия и хлора, невозможно приготовление пищи. Напомним:
Слово ион в переводе с греческого означает «странствующий». В растворах ионы беспорядочно передвигаются («странствуют») в различных направлениях. По составу ионы делят на простые — Сl-, Na+ и сложные —
В результате взаимодействия электролита с молекулами воды образуются гидратированные, т. е. связанные с молекулами воды, ионы. Следовательно, по наличию водной оболочки ионы делят на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях). Свойства гидратированных и негидратированных ионов отличаются, как вы смогли уже убедиться на примере ионов меди.
Следовательно, существует ещё одна классификация ионов — по знаку их заряда. В растворах электролитов сумма зарядов катионов равна сумме зарядов анионов, вследствие чего эти растворы электронейтральны.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации слабых электролитов вместо знака равенства ставят знак обратимости, например:
Степень диссоциации зависит от природы электролита и его концентрации. По степени диссоциации электролиты делят на сильные и слабые.
По характеру образующихся при диссоциации электролитов ионов различают три типа электролитов: кислоты, основания и соли.
|
|
|





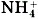 .
.





