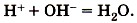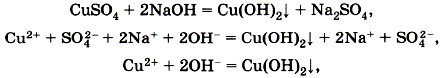|
|
|
|
|
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции Ионные уравненияТаким образом, сокращённые ионные уравнения представляют собой уравнения в общем виде, которые характеризуют сущность химической реакции и показывают, какие ионы реагируют и какое вещество образуется в результате.
Если к раствору гидроксида натрия, окрашенного фенолфталеином в малиновый цвет, прилить избыток раствора азотной кислоты (рис. 133), то раствор обесцветится, что послужит сигналом протекания химической реакции:
Полное ионное уравнение этой реакции:
Но поскольку ионы Na+ и
Оно показывает, что взаимодействие сильной кислоты и щёлочи сводится к взаимодействию ионов Н+ и ионов ОН-, в результате которого образуется малодиссоциирующее вещество — вода.
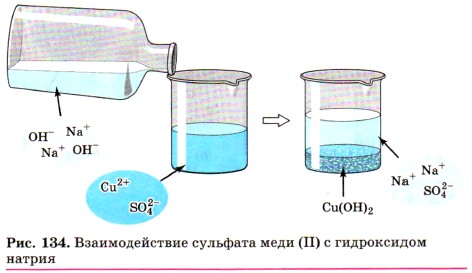
Подобная реакция обмена может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями. Например, если получить голубой осадок нерастворимого гидроксида меди (II) взаимодействием сульфата меди (II) с щёлочью (рис. 134):
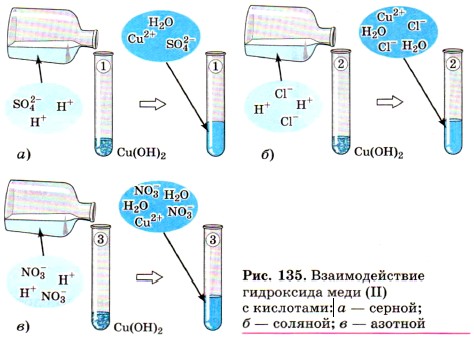
а затем поделить полученный осадок на три части и прилить к осадку в первой пробирке раствор серной кислоты, к осадку во второй пробирке — соляной кислоты, а к осадку в третьей пробирке раствор азотной кислоты,
то во всех трёх пробирках осадок растворится (рис. 135). Это будет означать, что во всех случаях прошла химическая реакция, суть которой и отражена с помощью одного и того же ионного уравнения.
Чтобы в этом убедиться, запишите молекулярные, полные и сокращённые ионные уравнения приведённых реакций.
|
|
|




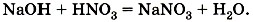
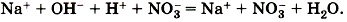
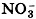 в растворе остаются в неизменном виде, то их можно не писать, и в конечном итоге сокращённое ионное уравнение реакции записывают так:
в растворе остаются в неизменном виде, то их можно не писать, и в конечном итоге сокращённое ионное уравнение реакции записывают так: