|
|
|
|
|
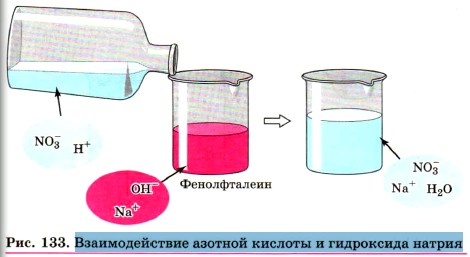
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции § 38. Ионные уравненияБольшинство химических реакций протекает в растворах. Растворы электролитов содержат ионы, поэтому реакции в растворах электролитов фактически сводятся к реакциям между ионами.
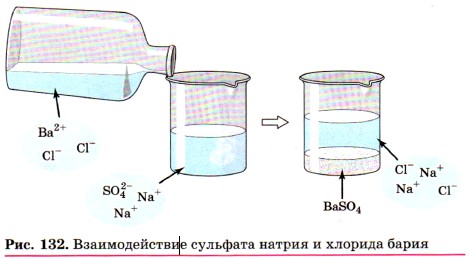
При составлении ионных уравнений следует руководствоваться тем, что формулы веществ малодиссоциирующих, нерастворимых и газообразных записывают в молекулярном виде. Если вещество выпадает в осадок, то, как вы уже знаете, рядом с его формулой ставят стрелку, направленную вниз (↓), а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх (↑). Например, если к раствору сульфата натрия Na2SO4 прилить раствор хлорида бария ВаСl2 (рис. 132), то в результате реакции образуется белый осадок сульфата бария BaSO4. Запишем молекулярное уравнение реакции:
Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а уходящие из сферы реакции — в виде молекул:
Мы записали, таким образом, полное ионное уравнение реакции. Если исключить из обеих частей равенства
одинаковые ионы, т. е. ионы, не участвующие в реакции (2Na+ и 2Сl- в левой и правой частях уравнения), то получим сокращённое ионное уравнение реакции:
Это уравнение показывает, что сущность реакции сводится к взаимодействию ионов бария Ва2+ и сульфат-ионов
|
|
|




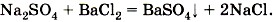
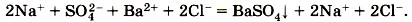
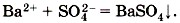
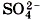 , в результате которого образуется осадок BaSO4. При этом совершенно не имеет значения, в состав каких электролитов входили эти ионы до реакции. Аналогичное взаимодействие можно наблюдать и между K2SO4 и Ba(NO3)2, H2SO4 и ВаСl2.
, в результате которого образуется осадок BaSO4. При этом совершенно не имеет значения, в состав каких электролитов входили эти ионы до реакции. Аналогичное взаимодействие можно наблюдать и между K2SO4 и Ba(NO3)2, H2SO4 и ВаСl2.