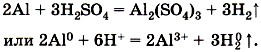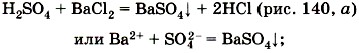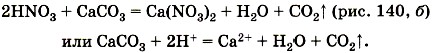|
|
|
|
|
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции § 39. Кислоты (окончание)Разбавленный раствор серной кислоты взаимодействует с металлами, стоящими в ряду напряжений до водорода, образуя соль и водород. Например,
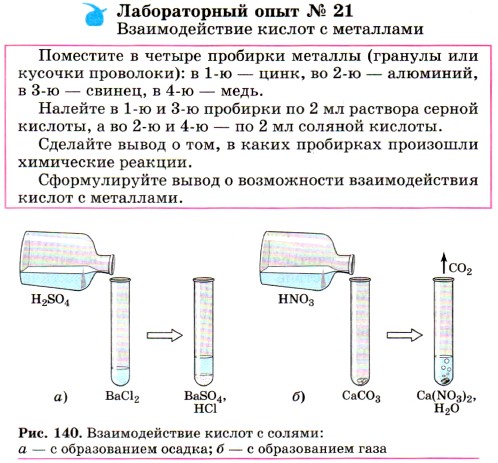
Четвёртая реакция — типичная реакция ионного обмена, протекающая только в случае, если образуется: 1) осадок, например:
2) газ, например:
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Выберите формулу сильной кислоты: a) H2S; б) HNO3; в) H2SiO3. Запишите уравнение диссоциации кислоты. 2. Дайте характеристику азотистой кислоты, используя различные признаки классификации кислот. 3. Определите степени окисления элементов в следующих кислотах: хлорной НСlO4, хромовой Н2СrO4, двухромовой Н2Сr2O7, азотистой HNO2, пирофосфорной Н4Р2O7. 4. Закончите молекулярные уравнения возможных реакций и запишите соответствующие им ионные уравнения: a) ZnO + HNO3 →
Если реакция не может быть осуществлена, объясните почему. 5. Рассчитайте объём водорода (н. у.), который выделится при растворении в соляной кислоте 120 г магния, содержащего 2,5% примесей. 6. Запишите формулы оксидов, соответствующих следующим кислотам: HNO2, HNO3, H3PO4, H2SO3, H2SO4, H2SiO3. <<< К началу Ответы к § 39 >>>
|
|
|