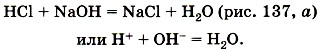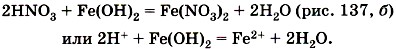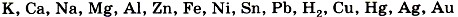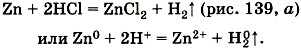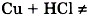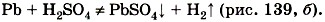|
|
|
|
|
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции Кислоты, их классификация и свойстваПервая реакция протекает между любыми кислотами и основаниями (как с растворимыми, так и с нерастворимыми). Например, реакция кислоты с щёлочью (реакция нейтрализации):
Аналогично протекает эта реакция и с нерастворимыми основаниями, например:
Вторая реакция протекает между оксидами металлов и большинством кислот, например:
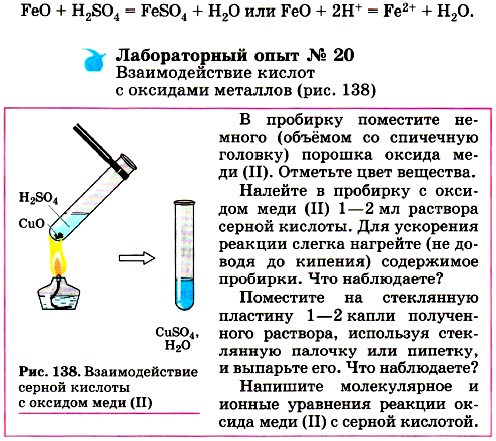
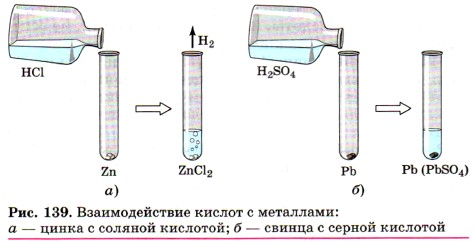
Чтобы прошла третья реакция, необходимо выполнить несколько условий. 1) Металл должен находиться в ряду напряжений (с ним вы уже знакомились в § 32):
до водорода. Например,
А вот реакция между соляной кислотой и медью невозможна, так как медь стоит в ряду напряжений после водорода.
2) Должна получиться растворимая соль. Во многих случаях взаимодействие металла с кислотой практически не происходит потому, что образующаяся соль нерастворима и покрывает поверхность металла защитной плёнкой, например:
Нерастворимый сульфат свинца (II) прекращает доступ кислоты к металлу, и реакция прекращается, едва успев начаться. По данной причине большинство тяжёлых металлов практически не взаимодействуют с фосфорной, угольной и сероводородной кислотами. 3) Реакция характерна для растворов кислот, поэтому нерастворимые кислоты, например кремниевая, не вступают в реакции с металлами. 4) Концентрированный раствор серной кислоты и раствор азотной кислоты любой концентрации взаимодействуют с металлами иначе, поэтому уравнения реакций между металлами и этими кислотами записывают по другой схеме.
|
|
|