|
|
|
|
|
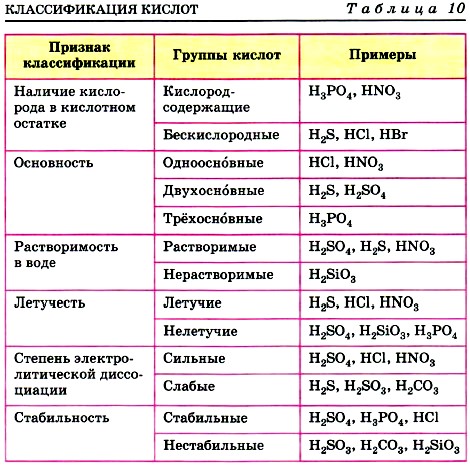
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции § 39. Кислоты, их классификация и свойстваРазделение кислот на группы по различным признакам представлено в таблице 10.
При обычных условиях кислоты могут быть твёрдыми (фосфорная Н3РO4, кремниевая H2SiO3) и жидкими (в чистом виде жидкостью будет серная кислота H2SO4). Такие газы, как хлороводород НСl, бромоводород НВr, сероводород H2S, в водных растворах образуют соответствующие кислоты. Вы уже знаете, что угольная Н2СO3 и сернистая H2SO3 кислоты существуют только в водных растворах, так как являются слабыми и нестойкими. Они легко разлагаются на оксиды углерода (IV) и серы (IV) — СO2 и SO2 соответственно — и воду. Поэтому выделить эти кислоты в чистом виде невозможно. Часто путают понятия «летучесть» и «устойчивость» (стабильность). Летучими называют кислоты, молекулы которых легко переходят в газообразное состояние, т. е. испаряются. Например, соляная кислота является летучей, но устойчивой, стабильной кислотой; нелетучая нерастворимая кремниевая кислота при стоянии разлагается на воду и оксид кремния (IV) SiO2. Водные растворы соляной, азотной, серной, фосфорной и ряда других кислот не имеют окраски. Водные растворы хромовой кислоты Н2СrO4 имеют жёлтую окраску, марганцевой кислоты НМnO4 — малиновую. Однако, какими бы разными ни были кислоты, все они образуют при диссоциации катионы водорода, которые и обусловливают ряд общих свойств: кислый вкус, изменение окраски индикаторов (лакмуса и метилового оранжевого), взаимодействие с другими веществами.
|
|
|