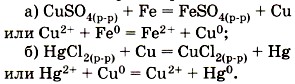|
|
|
|
|
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции Соли, их классификация и свойстваЧетвёртая реакция солей связана с именем крупнейшего русского химика Н. Н. Бекетова, который в 1865 г. изучал способность металлов вытеснять из растворов солей другие металлы. Например, медь из растворов её солей можно вытеснить такими металлами, как магний Mg, алюминий Аl, цинк Zn, и некоторыми другими. А вот ртутью Hg, серебром Ag, золотом Аu медь не вытесняется, и поэтому эти металлы в ряду напряжений расположены правее, чем медь. Зато медь вытесняет их из растворов солей:
Н. Н. Бекетов, действуя газообразным водородом под давлением на растворы солей ртути и серебра, установил, что при этом водород, так же как и некоторые другие металлы, вытесняет ртуть и серебро из их солей. Располагая металлы, а также водород по их способности вытеснять друг друга из растворов солей, Н. Н. Бекетов составил ряд, который он назвал вытеспительным рядом металлов. Позднее (1892 г., В. Нернст) было доказано, что вытеснительный ряд Н. Н. Бекетова практически совпадает с рядом, в котором металлы и водород расположены (слева направо) в порядке уменьшения их восстановительной способности (см. § 43) при t = 25 °С, р = 101,3 кПа (1 атм) и молярной концентрации ионов металла, равной 1 моль/л. Этот ряд называют электрохимическим рядом напряжений металлов. Вы уже знакомились с этим рядом, когда рассматривали взаимодействие кислот с металлами (§ 37 и 38) и выяснили, что с растворами кислот взаимодействуют металлы, которые расположены левее водорода. Это первое правило ряда напряжений (активности). Оно выполняется с соблюдением некоторых условий, о которых мы говорили ранее. Второе правило ряда напряжений заключается в следующем: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило также соблюдается при выполнении условий: а) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Из перечня формул выпишите отдельно формулы средних, кислых и основных солей, дайте их названия и запишите уравнения их диссоциации: Ca(HSO4)2, (CaOH)2SO4, Ca(NO3)2, NaH2PO4, Na3PO4, MgOHNO3. 2. Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения:
Если реакция не может быть осуществлена, объясните почему. К 980 г 5% -го раствора серной кислоты прилили избыток раствора нитрата бария. Найдите массу выпавшего осадка. Запишите уравнения реакций всех возможных способов получения сульфата железа (И). Определите степени окисления элементов в солях, формулы которых: Na2SO4, K2SO3, Fe(NO3)3, Fe(NO2)2, Mg(HCO3)2, Ca3(PO4)2, NaHSO4, CuOHNO3. Дайте названия солей. <<< К началу Ответы к § 42 >>>
|
|
|