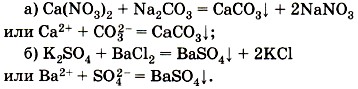|
|
|
|
|
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции § 42. Соли, их классификация и свойстваИз всех неорганических соединений соли являются наиболее многочисленным классом веществ. Это твёрдые вещества, они отличаются друг от друга по цвету и растворимости в воде.
В начале XIX в. шведский химик Й. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например: Na2CO3 — карбонат натрия,
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
К кислым солям относят, например, питьевую соду NaHCO3, состоящую из катиона металла Na+ и кислотного однозарядного остатка Названия этих солей складывают из названий средних солей с прибавлением слова гидро-, например: Mg(HSO4)2 — гидросульфат магния. Диссоциируют кислые соли следующим образом:
Например, к таким солям относится знаменитый малахит (CuOH)2CO3, о котором вы читали в сказах П. Бажова. Он состоит из двух гидроксокатионов СuОН+ и двухзарядного аниона кислотного остатка Катион СuОН+ имеет заряд 1+, поэтому в молекуле два таких катиона и один двухзарядный анион Названия таких солей будут такими же, как и у средних солей, но с прибавлением слова гидроксо-, например (CuOH)2CO3 — гидроксокарбонат меди (II) или АlOНСl2 — гидроксохлорид алюминия. Подавляющее большинство основных солей нерастворимы или малорастворимы. Последние диссоциируют так:
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
|
|
|






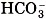 . Для аналогичной кислой соли кальция формулу записывают так: Са(НСO3)2.
. Для аналогичной кислой соли кальция формулу записывают так: Са(НСO3)2.

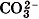 .
.