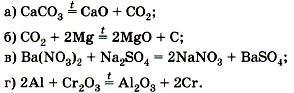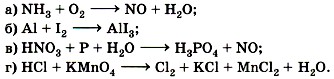|
|
|
|
|
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции § 44. Окислительно-восстановительные реакции (окончание)Проверим правильность расстановки коэффициентов, подсчитав число атомов кислорода до и после реакции: до реакции — 24 атома и после реакции — 24 атома. Коэффициенты расставлены правильно, поэтому заменим в уравнении стрелку на знак равенства:
Зная формулу вещества и определив степени окисления атомов химических элементов в нём, нетрудно предсказать, какие свойства будет проявлять каждый элемент и вещество в целом: окислительные или восстановительные. Например, азот в азотной кислоте имеет максимальное значение степени окисления +5, т. е. он «потерял» все электроны, поэтому Другой пример — оксид азота (II) Приведём примеры важнейших восстановителей и окислителей. Восстановители: активные металлы, водород, уголь, оксид углерода (II) СО, сероводород H2S, аммиак NH3 и т. д. Окислители: кислород, галогены; азотная HNO3 и серная H2SO4 кислоты, перманганат калия КМnO4 и др.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Какие из реакций, уравнения которых записаны ниже, относят к окислительно-восстановительным?
Для окислительно-восстановительных реакций укажите окислитель и восстановитель, процессы окисления и восстановления, составьте электронные уравнения. 2. Дайте характеристику реакции синтеза аммиака по всем изученным вами признакам классификации химических реакций. 3. Из следующих утверждений выберите истинные: а) к окислительно-восстановительным будут относиться все реакции ионного обмена;
Обоснуйте свою точку зрения, докажите её примерами уравнений реакций. 4. Согласны ли вы с утверждением, что HNO3 проявляет только окислительные свойства, a NH3 — только восстановительные? Ответ обоснуйте. 5. Какое из веществ — сероводород H2S и серная кислота H2SO4 — проявляет только окислительные или только восстановительные свойства? Почему? 6. Обоснуйте тезис, что SO2 может быть и окислителем, и восстановителем. 7. Расставьте коэффициенты методом электронного баланса в следующих схемах реакций:
8. Назовите окислитель в реакциях взаимодействия цинка с соляной и азотной кислотами. Для последней реакции используйте аналогию взаимодействия азотной кислоты с медью. <<< К началу Ответы к § 44 >>>
|
|
|



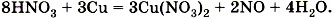
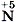 в азотной кислоте будет проявлять только окислительные свойства. Азот в аммиаке
в азотной кислоте будет проявлять только окислительные свойства. Азот в аммиаке 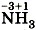 имеет минимальное значение степени окисления - 3 , т. е. он не сможет принять больше ни одного электрона, и поэтому аммиак будет проявлять только восстановительные свойства.
имеет минимальное значение степени окисления - 3 , т. е. он не сможет принять больше ни одного электрона, и поэтому аммиак будет проявлять только восстановительные свойства.
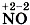 . Азот в этом соединении имеет промежуточное значение степени окисления и поэтому может проявлять как окислительные (например:
. Азот в этом соединении имеет промежуточное значение степени окисления и поэтому может проявлять как окислительные (например: 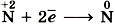 или
или 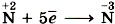 ), так и восстановительные (например:
), так и восстановительные (например: 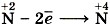 ) свойства.
) свойства.