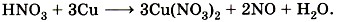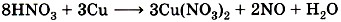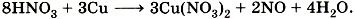|
|
|
|
|
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции Окислительно-восстановительные реакции
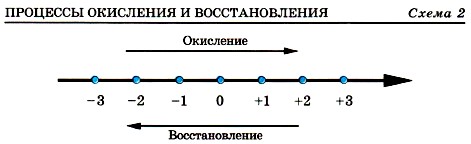
Окисление всегда сопровождается восстановлением и наоборот, т. е. окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления. Схема взаимосвязи изменения степеней окисления с процессами окисления и восстановления может быть представлена так, как это изображено на схеме 2.
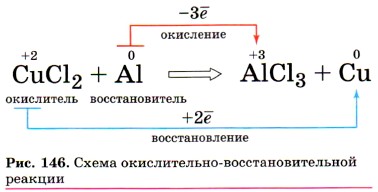
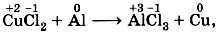
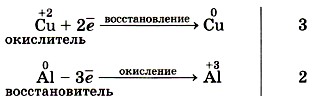
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т. е. соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления. Например, реакцию алюминия с хлоридом меди (II) описывают схемой (рис. 146):
а электронные уравнения будут иметь вид:
Молекулярное уравнение этой реакции написать уже несложно, так как коэффициенты для него будут взяты из электронных уравнений:
Покажем, как с помощью метода электронного баланса можно расставить коэффициенты в уравнении сложной окислительно-восстановительной реакции. Как вы помните, первое правило ряда напряжений металлов о взаимодействии металлов с растворами кислот не распространялось на серную кислоту концентрированную и азотную кислоту любой концентрации. В отличие от соляной кислоты, в которой окислителем атомов металла были катионы водорода, в концентрированной серной и азотной кислотах окислителями являются атомы серы и азота из сульфат-ионов и нитрат-ионов. Поэтому концентрированная H2SO4 и HNO3 любой концентрации взаимодействуют с металлами, стоящими в ряду напряжений как до водорода, так и после него, восстанавливаясь при этом до SO2, NO и т. д. Например, при взаимодействии разбавленной азотной кислоты с медью получается нитрат меди (II), оксид азота (II) и вода. Запишем формулы исходных веществ и продуктов реакции с указанием степеней окисления:
Подчеркнём знаки химических элементов, изменивших свои степени окисления:
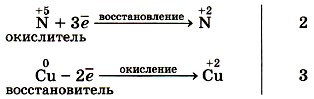
Составим электронные уравнения, т. е. отразим процессы отдачи и присоединения электронов:
Запишем коэффициент 3 перед
Теперь уравняем число атомов азота. После реакции оно равно 3 • 2 = 6 из Cu(NO3)2 и ещё 2 атома из 2NO, всего 8. Поэтому перед HNO3 запишем коэффициент 8:
и уравняем число атомов водорода:
|
|
|




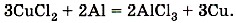
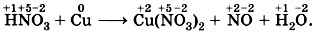
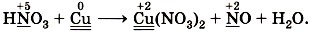
 и перед формулой нитрата меди (II), в котором
и перед формулой нитрата меди (II), в котором 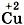 , так как с такими значениями степеней окисления медь встречается по одному разу. Коэффициент 2 запишем только перед формулой вещества с
, так как с такими значениями степеней окисления медь встречается по одному разу. Коэффициент 2 запишем только перед формулой вещества с 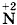 , так как это значение степени окисления для азота в схеме реакции встречается только один раз, а вот перед HNO3 коэффициент 2 не запишем, ибо
, так как это значение степени окисления для азота в схеме реакции встречается только один раз, а вот перед HNO3 коэффициент 2 не запишем, ибо 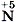 встречается ещё раз в формуле Cu(NO3)2. Наша запись примет вид:
встречается ещё раз в формуле Cu(NO3)2. Наша запись примет вид: