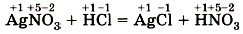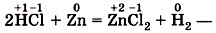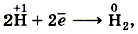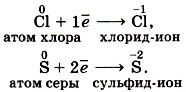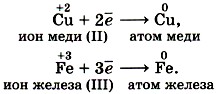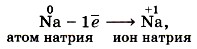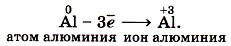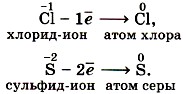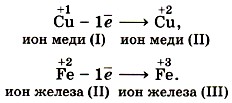|
|
|
|
|
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции § 44. Окислительно-восстановительные реакцииМногообразие классификаций химических реакций по различным признакам (направлению, числу и составу реагирующих и образующих веществ, использованию катализатора, тепловому эффекту) можно дополнить ещё одним признаком. Этот признак — изменение степени окисления атомов химических элементов, образующих реагирующие вещества. Например, в реакции
степени окисления атомов химических элементов после реакции не изменились. А вот в другой реакции — взаимодействие соляной кислоты с цинком
атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород с +1 на 0, а цинк — с О на +2. Следовательно, в этой реакции каждый атом водорода получил по одному электрону
а каждый атом цинка отдал два электрона
Под восстановлением понимают процесс присоединения электронов атомами, ионами или молекулами. Степень окисления при этом понижается. Например, атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные ионы, т. е. восстанавливаясь1: 1 Далее мы будем указывать степень окисления, а не заряды ионов, так как их численные значения совпадают.
Электроны могут присоединяться и к положительным ионам, которые при этом превращаются в атомы:
Принимать электроны могут и положительные ионы, у которых при этом степень окисления понижается:
Под окислением понимают процесс отдачи электронов атомами, ионами или молекулами. Например, атомы металлов, теряя электроны, превращаются в положительные ионы, т. е. окисляются:
Отдавать электроны могут отрицательные ионы:
Терять электроны могут и некоторые положительные ионы с низшими степенями окисления:
Можно отметить, что при этом степень окисления повышается.
|
|
|