|
|
|
|
|
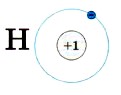
Глава первая. Атомы химических элементов Строение электронных оболочек атомовЯдро атома водорода имеет заряд +1, т. е. содержит только один протон, соответственно только один электрон на единственном энергетическом уровне:
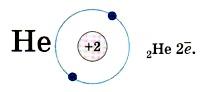
Это записывают с помощью электронной формулы следующим образом: 2Н 1 Следующий элемент 1-го периода гелий. Ядро атома гелия имеет заряд +2. У него на первом энергетическом уровне имеются уже два электрона:
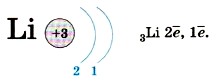
На первом энергетическом уровне могут поместиться только два электрона и никак не больше — он полностью завершён. Потому-то 1-й период таблицы Д. И. Менделеева и состоит из двух элементов. У атома лития, элемента 2-го периода, появляется ещё один энергетический уровень, на который и «отправится» третий электрон:
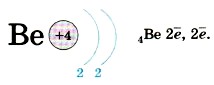
У атома бериллия на второй уровень «попадает» ещё один электрон:
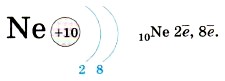
Атом бора на внешнем уровне имеет три электрона, а атом углерода — четыре электрона... атом фтора — семь электронов, атом неона — восемь электронов:
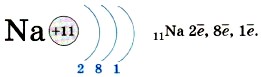
Второй уровень может вместить только восемь электронов, и поэтому он завершён у неона. У атома натрия, элемента 3-го периода, появляется третий энергетический уровень (обратите внимание — атом элемента 3-го периода содержит три энергетических уровня!), и на нём находится один электрон:
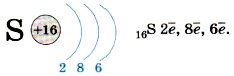
Обратите внимание: натрий — элемент I группы, на внешнем энергетическом уровне у него один электрон! Очевидно, нетрудно будет записать строение энергетических уровней для атома серы, элемента VIA группы 3-го периода:
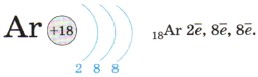
Завершает 3-й период аргон:
Атомы элементов 4-го периода конечно же имеют четвёртый уровень, на котором у атома калия находится один электрон, а у атома кальция — два электрона. Теперь, когда мы познакомились с упрощёнными представлениями о строении атомов элементов 1-го и 2-го периодов Периодической системы Д. И. Менделеева, можно внести уточнения, приближающие нас к более верному взгляду на строение атома. Начнём с аналогии. Подобно тому как быстро движущаяся игла швейной машинки, пронзая ткань, вышивает на ней узор, так и неизмеримо быстрее движущийся в пространстве вокруг атомного ядра электрон «вышивает», только не плоский, а объёмный рисунок электронного облака. Так как скорость движения электрона в сотни тысяч раз больше скорости движения швейной иглы, то говорят о вероятности нахождения электрона в том или ином месте пространства. Допустим, что нам удалось, как на спортивном фотофинише, установить положение электрона в каком-то месте около ядра и отметить это положение точкой. Если такой «фотофиниш» сделать сотни, тысячи раз, то получится модель электронного облака. Иногда электронные облака называют орбиталями. Поступим так и мы. В зависимости от энергии электронные облака, или орбитали, отличаются размерами. Понятно, что чем меньше запас энергии электрона, тем сильнее притягивается он к ядру и тем меньше по размерам его орбиталь.
|
|
|



 .
.