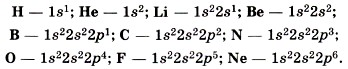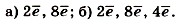|
|
|
|
|
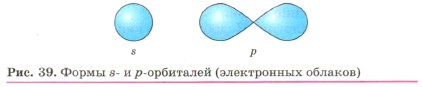
Глава первая. Атомы химических элементов § 9. Строение электронных оболочек атомов (окончание)Электронные облака (орбитали) могут иметь разную форму. Каждый энергетический уровень в атоме начинается с s-орбитали, имеющей сферическую форму. На втором и последующих уровнях после одной s-орбитали появляются р-орбитали гантелеобразной формы (рис. 39). Таких орбиталей три. Любую орбиталь занимают не более двух электронов. Следовательно, на s-орбитали их может быть только два, а на трёх р-орбиталях — шесть. Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и р, а число электронов данной орбитали арабской цифрой вверху справа над буквой, мы можем изобразить строение атомов более полными электронными формулами.
Запишем электронные формулы атомов 1-го и 2-го периодов:
Если элементы имеют сходные по строению внешние энергетические уровни, то и свойства этих элементов сходны. Например, аргон и неон содержат на внешнем уровне по восемь электронов, и потому они инертны, т. е. почти не вступают в химические реакции. В свободном виде аргон и неон — газы, молекулы которых одноатомны. Атомы лития, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу Периодической системы Д. И. Менделеева. Сделаем обобщение: одинаковое строение внешних энергетических уровней периодически повторяется, поэтому периодически повторяются и свойства химических элементов. Эта закономерность отражена в названии Периодической системы химических элементов Д. И. Менделеева.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Изобразите схемы строения электронной оболочки атомов: а) алюминия; б) фосфора; в) кислорода. 2. Сравните строение электронной оболочки атомов: а) азота и фосфора; б) фосфора и серы. 3. Впишите пропущенные слова в предложения: «Атом кремния содержит в ядре ... протонов и ... нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов, равно ... элемента. Число энергетических уровней определяется номером ... и равно . . . . Число электронов на внешнем электронном слое определяется номером ... и равно ...». 4. Определите положение химического элемента в Периодической системе Д. И. Менделеева по его электронной формуле:
5. Почему в 1-м периоде Периодической системы Д. И. Менделеева содержится только два элемента, а во 2-м — только восемь? 6. Приведите примеры периодически повторяющихся явлений, с которыми вы познакомились при изучении других учебных предметов. 7. Попробуйте дать собственное толкование следующих строк из стихотворения В. Брюсова «Мир электрона»: Быть может, эти электроны —
8. О каком поэтическом даре говорят приведённые выше строчки, если учесть, что стихотворение было написано в 1922 г.?
|
|
|