|
|
|
|
|
Глава 2. Химические реакции. Законы сохранения массы и энергии Составление уравнений химических реакций. Расчёты по химическим уравнениямРасчёты количеств веществ, участвующих в химических реакциях, называются стехиометрическими (стехиометрия — раздел химии, изучающий массовые и объёмные отношения между реагентами). Посмотрим, как можно по уравнениям определить массу и количество веществ, участвующих в реакции. Вспомним, что эти величины связаны между собой уравнением: При решении указанных задач целесообразно пользоваться алгоритмом.
При записи термохимического уравнения приводят тепловые эффекты реакций. Например, уравнение эндотермической реакции азота с водородом записывают так: N2 + O2 = 2NO - 180,8 кДж Основные понятия Химическое уравнение • Коэффициент • Индекс Вопросы и задания
а) 2Са + O2 = 2СаО б) Fe + S = FeS
a) Zn + S → ZnS б) Fe + O2 → Fe2O3 в) HgO → Hg + O2
|
|
|



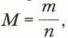 где М — молярная масса, г/моль; n — количество вещества, моль; m — масса вещества, г.
где М — молярная масса, г/моль; n — количество вещества, моль; m — масса вещества, г.

 1. Какие расчёты называются стехиометрическими? Для чего они применяются?
1. Какие расчёты называются стехиометрическими? Для чего они применяются?
 5. Какое количество вещества кислорода необходимо для получения 72 г воды из кислорода и водорода?
5. Какое количество вещества кислорода необходимо для получения 72 г воды из кислорода и водорода?
 6. Прочтите уравнения химических реакций и объясните их:
6. Прочтите уравнения химических реакций и объясните их: