|
|
|
|
|
Глава 2. Химические реакции. Законы сохранения массы и энергии § 19. Составление уравнений химических реакций. Расчёты по химическим уравнениям
Зная состав молекул исходных веществ и продуктов реакции, можно для любой реакции написать химическое уравнение, которое представляет собой условную запись химической реакции с помощью химических формул. В левой части уравнения пишут формулы исходных веществ, а в правой — формулы продуктов реакции. Коэффициенты в уравнении химической реакции рассчитывают на основании закона сохранения массы таким образом, чтобы число атомов одного элемента в левой и правой частях уравнения было одинаковым. Правила, которыми обычно пользуются при составлении химических уравнений, рассмотрены в алгоритме на примере реакции окисления алюминия: 4Аl + 3O2 = 2Аl2O3
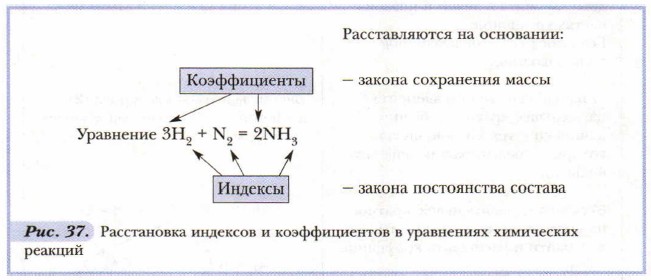
Прочтение химических уравнений. Между понятиями атом, молекула и моль существует определённое соотношение. Поэтому, например, уравнение реакции образования воды из водорода и кислорода 2Н2 + O2 = 2Н2O можно прочитать двумя способами. Первый: две молекулы водорода реагируют с одной молекулой кислорода, образуя две молекулы воды. Однако поскольку при этом имеется в виду лишь единичный акт химической реакции, соответствующий микросостоянию, а мы наблюдаем макросостояние, то более правильным будет второй способ прочтения: два моля водорода реагируют с одним молем кислорода, образуя два моля воды. Уравнения химических реакций составляют на основе законов сохранения массы и постоянства состава веществ (рис. 37). При составлении уравнений важно не путать коэффициенты и индексы и не изменять индексы в химических формулах.
Расчёты по уравнениям химических реакций
Уравнения реакции имеют огромное практическое значение для расчётов, связанных с той или иной реакцией.
|
|
|



 Какие науки используют уравнения для вычислений?
Какие науки используют уравнения для вычислений?