|
|
|
|
|
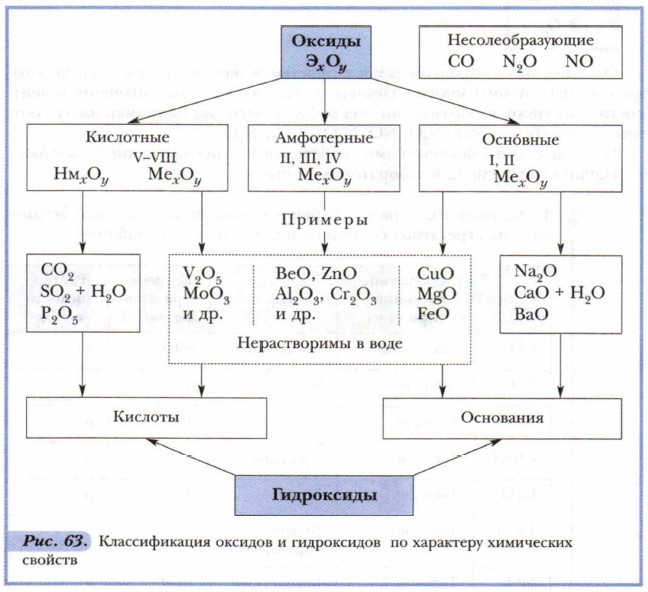
Глава 6. Основные классы неорганических соединений ОксидыПроведение опыта 2 убеждает не только в разной растворимости оксидов, но и в получении в результате растворения в воде соединений разного характера: в одном случае лакмус окрасился в синий цвет, в другом — стал красным. Это объясняется существованием разных оксидов, отличающихся по свойствам, — кислотных и основных. Рассмотрим рисунок 63.
Как видно из приведённых в схеме общих формул, осно́вные оксиды могут быть образованы металлами (Me), проявляющими валентность I и II. К кислотным относятся почти все оксиды, в состав которых входят, помимо кислорода, атомы неметаллов (Нм), а также оксиды металлов, проявляющих валентность более Металлы, проявляющие валентность III и IV, а иногда и II, образуют амфотерные оксиды. Эти оксиды отличаются от прочих особенностями химических свойств. Подробнее мы познакомимся с ними позже, а пока сосредоточим своё внимание на кислотных и основных оксидах. Многие кислоты и основания можно получить путём растворения соответствующих оксидов в воде. Растворение оксидов в воде — химический процесс, сопровождающийся образованием новых химических соединений:
Названия групп оксидов отражают их связь с другими классами неорганических соединений: большей части кислотных оксидов соответствуют кислоты, практически всем основным оксидам — основания. Однако не все оксиды растворимы (см. рис. 63). Так, большинство основных оксидов нерастворимы, и исключением из их числа являются лишь оксиды, образованные элементами главных подгрупп первой и второй групп периодической системы элементов (кроме MgO, ВеО): Li2O, Na2O, К2O, СаО, ВаО Задание. Найдите в таблице «Периодическая система химических элементов Д.И. Менделеева» знаки элементов-металлов, образующих растворимые в воде основные оксиды, и запомните их. Большинство же кислотных оксидов, напротив, растворимы в воде. Здесь исключением является, например, оксид кремния (IV) — SiO2. Это вещество вам хорошо знакомо. Оксид кремния составляет основу речного песка и многих минералов, в том числе редких и очень красивых: горного хрусталя, аметиста, цитрина, яшмы. Многие кислотные оксиды, образованные металлами, малорастворимы или нерастворимы. Если оксиды не растворяются в воде, то соответствующие им кислоты и основания получают иными способами (косвенным путём), с которыми мы познакомимся позже. Кислородсодержащие кислоты и основания называют гидроксидами. Это слово сложное. Оно состоит из двух частей: гидро (от греч. hydor— «вода») + оксид (от греч. oxys — «кислый»). Основные понятия Кислотные, осно́вные, амфотерные оксиды • Гидроксиды Вопросы и задания
|
|
|



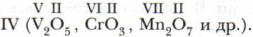
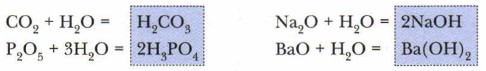
 1. Формулы только осно́вных оксидов приведены в ряду
1. Формулы только осно́вных оксидов приведены в ряду
 3. Что вы знаете о применении оксидов СO2, Н2O, SiO2 и др.? Составьте формулы оксидов: S(IV), Си (II), Fe (III), Hg(II), N(V), P(V), Se(VI), Cl (VII). Какие из них вступают в реакцию с водой? Составьте уравнения этих реакций.
3. Что вы знаете о применении оксидов СO2, Н2O, SiO2 и др.? Составьте формулы оксидов: S(IV), Си (II), Fe (III), Hg(II), N(V), P(V), Se(VI), Cl (VII). Какие из них вступают в реакцию с водой? Составьте уравнения этих реакций.