|
|
|
|
|
Глава 6. Основные классы неорганических соединений § 35. Химические свойства кислот
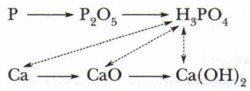
Вы уже знаете, что бо́льшая часть металлов и неметаллов способна вступать в цепочки последовательных превращений, в результате которых из простых веществ можно получить их оксиды и гидроксиды. Такие цепочки в химии называются генетическими рядами, так как они отражают генезис (происхождение) разных классов соединений и связи между ними. Приведём пример таких рядов:
Чтобы хорошо разобраться в химических свойствах кислот, в первую очередь следует помнить, что все они, как правило, способны вступать во взаимодействие со всеми членами генетического ряда металлов: самими металлами, их оксидами и гидроксидами (см. пунктирные линии в приведённом примере). Рассмотрим на примерах перечисленные общие свойства кислот. 1. Кислота + металл
В трёх первых пробирках протекают химические реакции. На поверхности металлов образуются пузырьки газа, которые быстро поднимаются вверх. Этот газ — водород. Мы уже знакомились с ним при изучении реакции разложения воды электрическим током. При поджигании выделяющегося водорода происходит характерный хлопок. В четвёртой пробирке никаких видимых изменений не происходит: медь не реагирует с растворами кислот. Дело в том, что возможность протекания реакции металлов с кислотами зависит от реакционной способности металлов, которая определяет их положение в ряду активности металлов. Для рассматриваемых нами свойств кислот важно следующее: металлы, стоящие в этом ряду после водорода, не вытесняют его из растворов кислот. Это правило обобщено на рисунке 66.
|
|
|



 Какие правила техники безопасности следует соблюдать при работе с кислотами? Какую помощь нужно оказать человеку, получившему ожог кислотой?
Какие правила техники безопасности следует соблюдать при работе с кислотами? Какую помощь нужно оказать человеку, получившему ожог кислотой?
 В четыре пробирки поместите по одной-две стружки или гранулы металлов: магния, цинка, железа и меди. К металлам прилейте разбавленные растворы серной или соляной кислот. Что происходит?
В четыре пробирки поместите по одной-две стружки или гранулы металлов: магния, цинка, железа и меди. К металлам прилейте разбавленные растворы серной или соляной кислот. Что происходит?
