|
Для характеристики ковалентной связи необходимо знать её свойства. К таковым относятся прочность (энергия), длина, направленность, полярность, насыщаемость. С полярностью ковалентной связи вы уже познакомились.
Важнейшим свойством ковалентной связи является её прочность. Она определяется энергией связи. Вы уже знаете, что при образовании химической связи выделяется энергия — это экзотермический процесс. При образовании Н2 выделяется 431 кДж/моль, при образовании HF — 565 кДж/моль (энергия связи измеряется в килоджоулях на один моль вещества).
Прочность молекул увеличивается с увеличением кратности связи между её атомами:
Длина связи — другое её свойство. Длину связи измеряют в нанометрах (1 нм = 1 • 10-9 м). Длина связи зависит от радиуса взаимодействующих атомов, от кратности связи между ними. Прочность молекул увеличивается с уменьшением длины между их атомами и повышением её энергии.
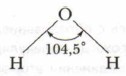
Направленность ковалентной связи. Установлено, что при взаимодействии кислорода с атомами водорода образуются две химические связи О—Н. В молекуле воды они образуют угол. Однако экспериментально установлено, что угол связи Н—О—Н в молекуле воды равен не 90°, а 104,5° вследствие их взаимного отталкивания. Поэтому угол между связями ОН в молекуле воды увеличивается:
Направленность химических связей в молекуле определяет её пространственную форму, или «геометрию» молекул. У молекулы воды угловая форма. Позже вы узнаете причину этого.
Молекулы разных веществ могут иметь линейное, угловое, пирамидальное и другое строение, плоскостную и неплоскостную формы.
Двухатомные ковалентные молекулы (Н2, Cl2, НСl и др.) линейной формы. Трёхатомные молекулы могут иметь линейную (С02) или угловую (Н2O) форму. У четырёхатомных молекул аммиака пирамидальное строение. Причины разной геометрии молекул вы узнаете позже.
Насыщаемостью связи называют способность атомов образовывать строго определённое число ковалентных связей.
| 


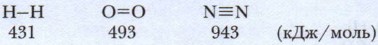
 1. Дайте определение ковалентной связи и опишите её свойства.
1. Дайте определение ковалентной связи и опишите её свойства.
 2. Как образуется ковалентная связь? Поясните на примере схем её образования между атомами в молекулах водорода и бромоводорода.
2. Как образуется ковалентная связь? Поясните на примере схем её образования между атомами в молекулах водорода и бромоводорода.