|
|
|
|
|
Глава 9. Строение вещества § 46. Ионная связь и её свойства
Примером связи между атомами типичного металла и типичного неметалла можно назвать связь атомов в хлориде натрия (поваренная соль). Составляющие её элементы — натрий и хлор находятся в 3-м периоде периодической системы. Их ОЭО соответственно равна у Na — 1,1, у Cl — 2,8. На внешнем электронном слое у атома натрия находится 1 неспаренный 5-электрон, у атома хлора из 7 внешних электронов 1 р-электрон неспаренный. За счёт неспаренных электронов между атомами натрия и хлора может образоваться химическая связь. Из-за большой разницы электроотрицательности способ её образования будет иной: за счёт отдачи и присоединения электронов. Отдав свой электрон атому хлора, атом натрия приобретает устойчивую оболочку инертного газа неона и превращается в положительно заряженную частицу — ион Na+. Атом хлора, приобретая электрон натрия, достраивает внешний электронный слой до устойчивой структуры инертного газа аргона — приобретает отрицательный заряд, превращаясь в ион Сl-. Ионы (от греч. ion — «идущий») — электрически заряженные частицы, которые образуются в результате потери или присоединения электронов (или других заряженных частиц) атомами или группами атомов. Положительно заряженные ионы называют катионами, а отрицательно заряженные ионы — анионами. Между ними возникают силы электростатического притяжения. За счёт этих сил разноимённо заряженные ионы связываются между собой, образуя ионное соединение Na+Cl- (поваренная соль):
Следует учитывать: а) чем левее и ниже находится в периодической системе элемент, тем легче его атомы переходят в катионы (отдают электроны); б) чем правее и выше расположен в периодической системе элемент, тем сильнее проявляют его атомы тенденцию переходить в анионы (принимать электроны). При переходе нейтральных атомов в ионы размер и свойства их меняются. Связь атомных частиц в ионном соединении объясняется не повышенной плотностью двухэлектронного облака (общей электронной пары), а силами электростатического притяжения ионов.
Ионных соединений сравнительно немного. Их образуют типичные металлы и неметаллы, резко отличающиеся по своей электроотрицательности. Примерами таких соединений являются хлорид натрия, хлорид калия, фторид лития и другие галогениды щелочных металлов Ме+Г- (здесь Г — галоген). С помощью ионной связи образуются и более сложные ионные соединения: щёлочи, соли, у которых сложный анион (ОН-,
|
|
|



 Вы познакомились с образованием ковалентной связи между атомами в простых и сложных молекулярных веществах. Можете ли вы привести примеры соединений атомов разных по характеру элементов? Как связываются друг с другом атомы элементов, которые резко отличаются по своему характеру и электроотрицательности?
Вы познакомились с образованием ковалентной связи между атомами в простых и сложных молекулярных веществах. Можете ли вы привести примеры соединений атомов разных по характеру элементов? Как связываются друг с другом атомы элементов, которые резко отличаются по своему характеру и электроотрицательности?
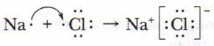
 Химическая связь между ионами, осуществляемая силами их электростатического притяжения, называется ионной связью, а соединения, которые образовались вследствие притяжения ионов, называются ионными.
Химическая связь между ионами, осуществляемая силами их электростатического притяжения, называется ионной связью, а соединения, которые образовались вследствие притяжения ионов, называются ионными.

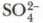 и т.д.).
и т.д.).